Wikichicos/Química/Texto completo
Índice
.....................................................................................................................................................
2º "El trozo más pequeño" o si existe un límite a la divisibilidad.
3º "¿De qué está hecho todo?", tarea compartida entre la química, la física y la filosofía.
4º "Semejanzas y diferencias" entre diferentes
5º "¿Ha cambiado?" o diferencia entre reacción química y cambio de estado.
6º "El agua" características y aplicaciones.
7º "El fuego" características
8º "Los elementos químicos y los compuestos químicos"
9º "La tabla periódica de los elementos"
|
11º "Reacciones químicas"
12º "Las mezclas"
13º "Clasificación de los compuestos químicos"
14º "Formulación de los compuestos"
15º "Compuestos químicos: Óxidos"
16 "Compuestos químicos: Hidruros"
17º "Compuestos químicos: Hidróxidos"
18º "Compuestos químicos: Oxácidos"
19º "Compuestos químicos: Sales binarias"
20º "Compuestos químicos: Oxisales"
|
-------------------------------------------------------------------------------------------------------------------
La materia

La materia o sustancia es todo aquello que tiene masa y conserva un lugar en el espacio, es decir, todo lo que nos rodea: la tierra, el agua, el aire, las nubes, las plantas.... Está formada por partículas muy pequeñas llamadas átomos.
Los átomos

Los átomos son muy pequeños y no los podemos ver a simple vista. Tan pequeños que si tomamos una bolita de plastilina lo más pequeña que podamos en ella habría millones de átomos.
Las partes principales del átomo son las siguientes:[1]
- Núcleo: es el lugar ocupado por las partículas más pequeñas que el átomo que son los neutrones y los protones
- Neutrones. Tienen masa pero no carga eléctrica.
- Protones. Poseen carga eléctrica positiva (+). Tienen masa y es muy difícil que salgan del núcleo del átomo.
- Electrones. Poseen carga eléctrica negativa (-) y se desplazan en una órbita elíptica alrededor del núcleo del átomo. Tienen una masa muy pequeña.
- Órbitas. Caminos simulados que recorren los electrones al desplazarse alrededor del núcleo
Iones


El número de protones (carga positiva) y electrones (carga negativa) en un átomo es el mismo, por lo que las cargas se equilibran a cero, es decir el átomo en estado normal es eléctricamente neutro. Sin embargo, los iones tienen un número de electrones diferente al de protones, por lo que tienen una carga positiva o negativa.
Un ión es un un átomo o molécula cargada eléctricamente y que por lo tanto no es eléctricamente neutro. Esto se puede entender como que, a partir de un estado neutro de un átomo o molécula, se han ganado o perdido electrones; este fenómeno se conoce como ionización.
Cuando un átomo pierde o gana electrones se transforma en un ion y lleva carga eléctrica. Como el electrón tiene carga negativa, cuando se añaden uno o más electrones a un átomo eléctricamente neutro, se forma un ion cargado negativamente. Al perder electrones se produce un ion cargado positivamente. El número de protones no cambia cuando un átomo se convierte en un ion.
|
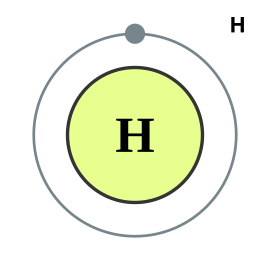
Por ejemplo el átomo de hidrógeno neutro tiene un protón en el núcleo y un electrón en la nube de electrones, pero si gana un electrón se convierte en un ión negativo y se representa como . En el caso del hidrógeno tendría un protón en el núcleo y dos electrones alrededor. Si pierde su único electrón se convierte en un ión positivo y se representa como .
|
|
Los iones positivos se llaman cationes y los iones negativos se llaman aniones. El número representa el número de electrones que le faltan o que tiene en demasía |
- Notaciones posibles de un ión
-
Anión (con el signo menos en este caso)
-
Anión bromo
-
Anión flúor
-
Catión calcio
-
Catión rubidio
- Notaciones posibles del anión cloro
- Notaciones posibles del catión sodio
Estados de la materia
La materia existe en tres formas, llamadas estados de la materia, que son: sólido, líquido y gaseoso.
| Estado | Ejemplo | Moléculas | Características |
|---|---|---|---|
| Sólido | hielo | Las moléculas están juntas, prácticamente no pueden moverse. | Por las características de las moléculas, un objeto sólido permanece con el mismo volumen y no cambia su forma. |
| Líquido | agua | Las moléculas continúan estando cerca pero no están unidas unas con otras. Se pueden mover. | Por las características de las moléculas, los líquidos pueden cambiar de forma y fluir, aunque al igual que un sólido, conserva el mismo volumen. |
| Gaseoso | vapor de agua | Las moléculas pueden moverse cerca o lejos unas de otras. | Por las características de las moléculas, un gas puede variar su volumen y tiende a rellenar el envase en el que está contenido. |

Moléculas

Una molécula es la cantidad más pequeña que puede existir de una sustancia química. Si una molécula se dividiera en trozos más pequeños, sería una sustancia diferente.
Las moléculas están formadas por átomos unidos de una forma determinada. Por ejemplo, los átomos de oxígeno siempre tienen dos enlaces con otros átomos, los átomos de carbono siempre tienen cuatro enlaces con otros átomos y los átomos de nitrógeno siempre tienen tres enlaces con otros átomos.
En gases como el aire, las moléculas simplemente vuelan. En los líquidos, como el agua, las moléculas están pegadas, pero pueden moverse. En los sólidos, como el azúcar, las moléculas sólo pueden vibrar.
Fórmula química

La fórmula indica qué átomos y cuántos de cada tipo hay en la molécula.
Las letra indica de qué elemento químico es cada átomo. Se llaman símbolos químicos y tienen una o dos letras.
Los subíndices son pequeños números situados en la parte inferior derecha de un símbolo. indican el número de cada tipo de átomo. Por ejemplo, el metano tiene un átomo de carbono (C) y cuatro átomos de hidrógeno (H); la fórmula química es CH4.
La molécula de azúcar glucosa tiene seis átomos de carbono, doce de hidrógeno y seis de oxígeno, por lo que su fórmula química es C6H12O6.
Las fórmulas químicas se utilizan en las ecuaciones químicas para describir las reacciones químicas.
Tipos de fórmulas
Hay tres tipos de fórmulas principales: fórmula molecular, fórmula estructural y fórmula tridimensional
- Fórmula molecular: indican simplemente los números de cada tipo de átomo en una molécula, sin información sobre la estructura. Por ejemplo, la fórmula molecular de la glucosa es (12 átomos de hidrógeno, 6 de carbono y 6 de oxígeno).
- Fórmula estructural: es una representación gráfica de la estructura molecular, que muestra cómo se ordenan o distribuyen espacialmente los átomos. Se muestran los enlaces químicos dentro de la molécula.
- Fórmula tridimensional: indica, además de los átomos que forman la molécula y los enlaces, la distribución de los átomos en el espacio.[2]
| Tipos de fórmulas | |||
|---|---|---|---|
| Compuesto | Fórmula molecular | Fórmula estructural | Fórmula tridimensional |
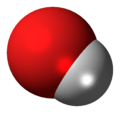
| Agua | H2O | 
| |
| Sal común (cloruro sódico) |
NaCl | NaCl | |
| Amoníaco | NH3 | 
|
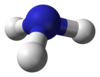
|
| Glucosa | C6H12O6 | 
|

|
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
Referencias
-------------------------------------------------------------------------------------------------------------------
La materia: Actividades
1.- Según la imagen del átomo de litio que tenemos abajo, realiza las imágenes del átomo de sodio, aluminio, potasio y oxígeno.

2.- Según el dibujo del catión sodio Na+

2.1.- Dibuja los cationes:
- Catión potasio K+
- Catión plata Ag+
2.2.- Dibuja los aniones:
- Anión cloro o cloruro Cl−
- Anión yodo o yoduro I−
3.- Dibuja cómo estarán las moléculas de agua en: un trozo de hielo, un vaso lleno de agua, un recipiente lleno de vapor de agua
4.- Colorea la molécula de CO2. El átomo central es el de carbono.

-------------------------------------------------------------------------------------------------------------------
El trozo más pequeño
Charla
El estímulo inicial puede surgir del juego de dividir. (Por ejemplo: ¿sabes cuántas veces puedes cortar por la mitad un folio?)
Se busca plantear la inquietud: "¿Cual es el trozo más pequeño que podríamos hacer?"
Se puede dejar al niño que postule respuestas. Quizá haya oído los términos "átomo", "molécula" o "célula". Si lo solicita, se le pueden aclarar estos términos con palabras sencillas, por ejemplo: "Si cogemos un trozo muy pequeño de tu piel, una célula es el trozo más pequeño que seguirá siendo piel, y que seguirá siendo tuyo. Será distinto de un trozo de músculo, o de un trozo de piel mía, y será muy parecido a cualquier otra célula de piel tuya. Si rompemos esa célula, dentro encontraremos muchas cosas. Una de ellas será agua. El trozo más pequeño de agua que podamos coger será una molécula de agua. Será distinta a otras moléculas, por ejemplo de azúcar, pero será igual que las moléculas de agua que hay en mis células, o en este vaso. Si rompemos el agua, tenemos átomos que se llaman de hidrógeno y de oxígeno. Los átomos de oxígeno del agua serán iguales que los átomos de oxígeno del aire."
Experimentos sencillos
- Si tenemos un microscopio en casa, podemos ver algunas células de piel (rascando con cuidado con la uña la cara interior de la mejilla se pueden obtener células epiteliales vivas).
- Si tenemos una lupa en casa, podemos mirar el aspecto del papel nuevo, y el aspecto de los bordes de papel rasgados. Se puede ver que, si siguiéramos rasgando, tendríamos algo distinto al papel.
- Si tenemos un dibujo o una foto (por ejemplo de una revista vieja), podemos partir varias veces la foto. Al principio, es una foto de algo (de un grupo de personas, o de un paisaje). A partir de cierto punto, sólo es un trocito de papel de color: hemos llegado a un tamaño más pequeño que el trozo más pequeño de foto de personas, o de paisajes.
-
Células de la piel vistas al microscopio
-
Escaneado de papel de filtro ampliado 840 veces en un microscopio electrónico de barrido
-
Si partimos la foto llegaremos a lo más pequeño, un trozo de papel de color
-------------------------------------------------------------------------------------------------------------------
¿De qué está hecho todo?
Charla
¿De qué esta hecho?
Esta motivación puede surgir en multitud de contextos, desde objetos de la vida cotidiana con componentes mecánicos o electrónicos (lo que da una orientación de la charla hacia la ingeniería) a los ingredientes de la comida o la bebida.
Es interesante destacar los componentes similares o distintos que podemos encontrar. Así, algunas prendas de ropa son del mismo tejido (algodón, lana, seda, sintéticos...) y sólo se diferencian en el color, la forma o el tamaño.
En alimentos, encontramos algunos ingredientes que se repiten una y otra vez (como pueden ser el agua, la sal, o el azúcar), y otros que aparecen más raramente. La inquietud a satisfacer en este caso, si surge, es:
¿y de qué componentes está hecho ese componente?.
Es muy enriquecedor estimular el interés por los componentes de cada aparato o alimento que nos encontramos, así como la satisfacción al ir avanzando hacia los componentes últimos.
Con palabras sencillas, se puede explicar que hay unos pocos componentes simples de los que están hechas casi todas las cosas que podemos tocar. E incluso, que esos componentes están a su vez hechos de otros pocos componentes aún más sencillos.
Una frase clásica que puede valer la pena comunicar es "La materia ni se crea ni se destruye, sólo se transforma".
Experimentos sencillos
Los cubitos de hielo están hechos de lo mismo que el agua de los vasos, aunque parezcan tan distintos.
Es muy fácil comprobar esto, preparando cubitos y dejándolos derretir luego. El que las nubes están hechas de lo mismo es creíble porque de ellas cae lluvia, pero parece difícil de verificar... sí que es posible ver cómo se condensa el vapor de la cocción en las tapas de las cacerolas al preparar la comida, para dar agua, lo cual es un fenómeno bastante similar.
Una lupa o un microscopio ayudan a ver cómo las cosas no tienen el mismo aspecto al verlas de cerca, y se puede sugerir que, si tuviéramos un microscopio de más aumentos, podríamos ver cada vez componentes más sencillos de la materia.
Algunos juegos de construcciones infantiles sencillos también son una buena metáfora de la arquitectura de la materia, como también lo son las pantallas de televisión cuando se miran muy de cerca.
-
Mosaico hecho con bloques
-
Cubitos de hielo, son agua sólida (congelada)
-
si se calientan se convierten en agua líquida.
-
Con una lupa se pueden ver las cosas con aspecto distinto a como las vemos normalmente
-------------------------------------------------------------------------------------------------------------------
Semejanzas y diferencias
Charla
El estímulo inicial puede venir de un juego: "¿A qué se parece esto?". El juego ha de buscar el equívoco lingüístico de la "semejanza", ya que un mismo objeto tiene diferentes cualidades, y se parecerá a unos u otros objetos dependiendo de la cualidad que se considere en cada momento.
Se busca plantear la inquietud: ¿En qué se pueden parecer dos cosas? Esta inquietud es la que está en el fondo de las propiedades químicas o la composición de las sustancias, pero no es necesario entrar en los conceptos químicos en esta etapa, si el niño no lo demanda.
Algunas de las respuestas nos alejan del tema, pero son igualmente enriquecedoras, como serían la función o el propietario de un objeto, o la habitación en la que se encuentra. Otras tendrán una relación más clara con la química, como el color, la forma, la textura (la sensación al tacto), el sabor, el olor, la facilidad para mezclarse con agua...
Experimentos sencillos
- El azúcar y la sal. Parecen iguales a la vista, o por lo menos muy parecidos. ¿Y si los miramos a la lupa o al microscopio? Por el sabor los distinguimos muy bien. ¿Y si ponemos una cucharada en un vaso de agua, y agitamos bien con una cuchara? Quizá al niño le sorprenda ver que la sal se disuelve en mucha mayor proporción que el azúcar...
-
granos de azúcar vistos con un microscopio
-
granos de sal vistos con un microscopio
- Identificar objetos metálicos, objetos de plástico, objetos de madera, objetos de vidrio... comprobar la diferencia que tienen al tacto, además de a la vista. ¿Cuales son más fríos? ¿Cuales son más brillantes? ¿Cuales son más ligeros? ¿Hacen ruido si se tocan golpean suavemente con la uña?
- Mezclar agua con aceite, agua con vinagre, aceite con vinagre. ¿Cuales se mezclan? ¿Y si probamos también con leche (agua con leche, aceite con leche, vinagre con leche)?
-
El aceite queda encima del agua, no se mezclan
-
Vinagre (oscuro) sobre aceite (amarillo)
|
Precaución: |
-------------------------------------------------------------------------------------------------------------------
¿Ha cambiado?
Existen tres tipos de cambios: las mezclas, los cambios físicos y los cambios químicos:
- Un cambio físico: es el cambio en el que la sustancia no cambia su composición solo cambia su estado, por ejemplo el agua (sólido-líquido-gaseoso).
- Un cambio químico: es el cambio en el que la sustancia sí cambia su composición, sería, por ejemplo, una combustión o la reacción que se da entre el vinagre (ácido acético) con bicarbonato de sodio.
-
Cristales de hielo fundiéndose para formar agua. un cambio físico del agua
-
La caramelización de un azucarillo es un cambio químico porque se produce un cambio de sustancias

- Una mezcla es una composición de mas de un componente: por ejemplo zumo de limón con bicarbonato
-
café con leche, una mezcla de dos sustancias
-
Mezcla de colorante alimentario en agua caliente a la derecha y en agua fría a la izquierda
- Hay diferentes cambios de estado o de fase: sólido-líquido, líquido-gaseoso, sólido-gaseoso, gaseoso-líquido y gaseoso - sólido.
-
el butano está en estado líquido en la bombona
-
En la cocina se convierte en gas que arde en el quemador
-------------------------------------------------------------------------------------------------------------------
El agua

El agua es una buena amiga en las tardes calurosas, tanto para beberla como para darnos un chapuzón refrescante, también es útil para preparar alimentos, lavar las frutas y hortalizas, así como en la higiene personal de utensilios y ropa, entre otros.
En su estado natural el agua es un líquido, pero se puede encontrar en otros dos estados de agregación, el sólido y el gaseoso.
Pero debemos recordar que para utilizarla, el agua debe estar libre de impurezas, es decir, el agua debe ser incolora, inodora e insípida.
Como cualquier otro líquido es capaz de adoptar la forma del recipiente que la contiene.
Dónde encontramos agua

Nuestro planeta está cubierto en un 60% de agua aproximadamente. Pero de toda esta agua existente, sólo un 3% es de agua dulce, apta para nuestro uso, el resto es salada.
Encontramos agua en los casquetes polares, los ríos, los lagos y el agua subterránea.
¿Es importante el agua?
El agua es de vital importancia para los seres vivos, tanto para el cumplimiento de sus ciclos biológicos como para las tareas cotidianas.
Sin embargo este recurso se vuelve cada vez más escaso, ya sea por efectos de la sequía, por el mal uso que le damos, así como por los efectos de la contaminación.
El agua siempre ha contribuido al avance de las sociedades, ya que permite el desarrollo de actividades económicas como:
- Uso industrial
- Uso en la agricultura y en la ganadería
- Turismo,
- Así también es el hábitat de miles de especies, como plantas, peces, otros animales, microorganismos importantes.
-
Uso industrial del agua. En una central para producir electricidad
-
Uso del agua en la agricultura. Riego de caña azucarera en el norte de Queensland, Australia
-
Uso del agua para el turismo. Piscina al aire libre en el balneario termal de Stegersbach, en Austria.
-
El agua es el hábitat de plantas, peces y otros muchos animales
¿Cómo usar correctamente el agua y así ahorrarla?

Consumir el agua de forma eficiente es muy fácil, siguiendo algunos de estos consejos puedes ayudar a ahorrar una enorme cantidad de agua:
- Nunca tires el agua sin antes cerciorarte que no puede tener otro uso, como por ejemplo: regar las plantas.
- Cuando te duches no abuses del agua, cierra el grifo mientras te enjabonas.
- No dejes que corra el agua mientras te lavas la cara o te cepillas los dientes.
- Riega las plantas al anochecer o amanecer, sin abusar del uso.
- Pide a las personas adultas que reparen algún grifo o ducha que gotee.
Poniendo en práctica estos consejos estarás ayudando a evitar la aceleración del proceso de degradación de los recursos hídricos.
Cómo está formada el agua?
El agua (del latín aqua) es una sustancia cuya molécula está compuesta por dos átomos de hidrógeno y uno de oxígeno (H2O). El término agua, generalmente, se refiere a la sustancia en su estado líquido, aunque esta puede hallarse en su forma sólida, llamada hielo, y en su forma gaseosa, denominada vapor. Es una sustancia bastante común en la Tierra y el sistema solar, donde se encuentra principalmente en forma de vapor o de hielo. Es indispensable para el origen y sustento de la vida.
¿Qué es el ciclo del agua?
El agua de los lagos, ríos, y especialmente de los océanos y de los mares, calentada por el sol se evapora. Algunos tipos de vegetación (por ejemplo, la selva) también despiden agua a causa de la evaporación y la transpiración de las plantas por las hojas. Esta agua luego llega a la atmósfera en forma de vapor. El aire caliente y húmedo se eleva y a medida que se eleva se enfría y las gotas de agua se unen para formar nubes, es el efecto de la condensación.
Esta agua contenida en las nubes cae en los océanos y continentes cuando llueve y nieva (precipitaciones). Cerca de los tres cuartos de las precipitación caen en los océanos y mares. En este caso el ciclo del agua es muy corto.
Cuando el agua cae sobre los continentes, corre o se infiltra (infiltración o flujo de agua subterránea). Parte de esta agua caída naturalmente se resta a la infiltración gracias a las plantas. El agua infiltrada llega en un tiempo más o menos largo, a un curso de agua. El agua vuelve así hasta los océanos, los lagos, y volverá a emprender otra vez el mismo camino, por lo que es un ciclo que se inicia cada vez. Sin embargo, parte del agua infiltrada es completamente atrapada por las rocas: forma las aguas subterráneas y es accesible excavando un pozo. Así se formaron durante la historia geológica de la Tierra, las capas freáticas que contienen el agua fósil.

Enlaces externos
- Agua en Wikipedia
- Ciclo del agua en Vikidia
- [3] Libro de actividades – El agua es vida. El agua nutre: No dejar a nadie atrás... - Organización de las Naciones Unidas para la Agricultura y la Alimentación - 2023
-------------------------------------------------------------------------------------------------------------------
El fuego
En la antigüedad clásica el fuego fue uno de los cuatro elementos clásicos, junto con el agua, el aire y la tierra. Los cuatro elementos representaban las cuatro formas conocidas de la materia y eran utilizados para explicar diferentes comportamientos de la naturaleza.

El fuego quizás es el descubrimiento más importante de la química, con el cocinamos y nos calentamos, técnicamente el fuego no es un elemento o un compuesto, más bien es una reacción química que se da por la interacción de tres componentes básicos que forman el triángulo de fuego:
- El combustible es el material que desprende el calor, este puede ser casi cualquier material inflamable como por ejemplo: leña, carbón, petróleo o gas natural.
- El comburente es el material que absorbe el calor y aviva el fuego, generalmente es un gas como sería el oxígeno.
- La energía de activación sería el aumento en la temperatura, este se da por una chispa que puede ser producto de fricción, percusión o bien por calentamiento del sol.
No recomendamos a nadie jugar con fuego y siempre mantenerse a una distancia considerable de este ya que una quemadura puede ser muy grave, por lo cual en caso de un incendio se deberá llamar a los bomberos para determinar la mejor manera de extinguir el fuego.
¿Cómo encender fuego?
Desde que el humano comenzó a dominar el fuego, se presentó un problema importante: encenderlo. De ahí que las religiones se convirtieran en las guardianas del fuego: mantener un fuego permanente era importante por si los fuegos domésticos se apagaban, y de ahí que todas las religiones, todavía ahora, mantengan un fuego encendido en el santuario.
Origen del fuego
Los primeros humanos pudieron haber observado que los fuegos naturales encendidos en el monte o el bosque por el rayo o los volcanes hacían huir a los animales y que ellos podían recoger en el suelo ramas muertas inflamadas tras el paso de un fuego. Al llevar esos rescoldos de regreso a donde vivían, habrían comenzado a utilizar el fuego.
Técnicas

Las dos técnicas tradicionales para producir fuego son:
- Frotar dos trozos de madera muy seca.
- Golpear una piedra dura contra otra. El uso de un mineral de hierro produce chispas que en contacto con el oxígeno en aire y unas hebras de madera fina pueden iniciar un fuego.
La domesticación o control del fuego

La domesticación o control del fuego fue un paso mayor en la evolución humana. Permitió a los hombres primitivos en primer lugar cocinar sus alimentos.
La cocción tuvo beneficios adicionales al eliminar la mayoría de parásitos y agentes patógenos y, a veces, también a toxinas que se encuentran en algunos vegetales crudos.
Además, el control del fuego y de la luz ocasionaron cambios importantes en su comportamiento ya que la actividad podía continuar en las horas de la noche y además proporcionaba protección ante los depredadores.
El uso controlado del fuego por el Homo erectus hace alrededor de un millón de años es ampliamente apoyado por los investigadores.
Incendios

Un incendio es una fuego no controlado que puede afectar o abrasar algo que no está destinado a quemarse. Puede afectar a seres vivos.
La exposición de los seres vivos a un incendio puede producir daños muy graves hasta la muerte, generalmente por inhalación de humo o por desvanecimiento producido por la intoxicación y posteriormente quemaduras graves.
Un incendio forestal es un tipo de incendio caracterizado por producirse y desarrollarse principalmente en zonas naturales con vegetación abundante.
Enlaces externos
-------------------------------------------------------------------------------------------------------------------
Los elementos químicos y los compuestos químicos
Elemento químico


Un elemento químico es una sustancia formada por un solo tipo de átomo. Los átomos están formados por protones, neutrones y electrones.


El número de protones de un átomo se denomina número atómico.[1] Por ejemplo, todos los átomos con 6 protones son átomos del elemento químico carbono, y todos los átomos con 92 protones son átomos del elemento uranio.
Decir que una sustancia "sólo contiene un tipo de átomo" significa en realidad que sólo contiene átomos que tienen todos el mismo número de protones.
El número de protones del núcleo determina su carga eléctrica. La carga eléctrica fija el número de electrones en su estado normal. Los electrones en sus orbitales atómicos determinan las distintas propiedades químicas del elemento.
La química moderna conoce 118 elementos químicos diferentes. 92 de estos elementos se encuentran en la naturaleza, y los demás sólo pueden fabricarse en laboratorios. El último elemento natural descubierto fue el uranio, en 1789. El primer elemento creado por el hombre fue el tecnecio, en 1937.
Los elementos químicos suelen ordenarse en la tabla periódica. El lugar que ocupan los elementos en la tabla nos informa de sus propiedades en relación con los demás elementos.
Símbolos químicos
Los elementos químicos reciben un símbolo químico único. Los símbolos químicos se utilizan en todo el mundo. Esto significa que, independientemente del idioma que se hable, no hay confusión sobre el significado del símbolo. Los símbolos químicos de los elementos casi siempre proceden de sus nombres en inglés o latín.
Por ejemplo:
- El carbono tiene el símbolo químico "C",
- El sodio tiene el símbolo químico "Na", del latín natrium.
- El tungsteno o wolframio se llama "W" por su nombre en alemán, wolfram.
- "Au" es el símbolo del oro y procede de la palabra latina para oro, aurum.
- Otro símbolo que procede del latín es "Ag" para la plata.
- El símbolo del plomo, "Pb", procede del latín plumbum y de él deriva la palabra inglesa plumber (fontanero), ya que las tuberías solían estar hechas de plomo.
- Algunos de los elementos descubiertos más recientemente llevan el nombre de personajes famosos, como el einsteinium, que debe su nombre a Albert Einstein.
- Nombres e imágenes de algunos elementos
-
Carbono "C"
-
Sodio "Na" de natrium
-
Wolframio "W" por su nombre en alemán, wolfram
-
Oro "Au" de aurum
-
Plata "Ag" de argentum
-
Plomo "Pb" de plumbum
-
Einsteinium "Es" de Albert Einstein
Clasificación

Los elementos pueden clasificarse en función de su estado físico. A temperatura y presión ambiente, la mayoría de los elementos son sólidos, sólo 11 son gases y 2 son líquidos.
Los elementos también pueden clasificarse en metales y no metales. Hay muchos más metales que no metales. ( Ver los metales y no metales en la tabla periódica de los elementos químicos)
Sin embargo, algunos elementos tienen propiedades intermedias entre los metales y los no metales. Estos elementos se denominan semimetales (o metaloides).
- Metal, no metal y semimetal
-
Hierro un elemento químico metal
-
El fósforo, un elemento químico no metal
-
El silicio, un elemento químico semimetal
Compuesto químico

Los elementos son los componentes básicos de todo tipo de sustancias. Si una sustancia contiene más de un tipo de átomo, se trata de un compuesto o una mezcla. La partícula más pequeña de un compuesto es una molécula.

Las propiedades de los compuestos
Las propiedades de los compuestos pueden ser muy diferentes de las de los elementos de los que están hechos. El sodio es un metal que arde cuando se introduce en agua y el cloro es un gas venenoso. Cuando reaccionan juntos forman cloruro sódico (la sal de mesa), que suele ser inofensivo en pequeñas cantidades y comestible.
Los compuestos químicos pueden ser sólidos, como el cloruro sódico, líquidos, como el agua, o gaseosos, como el dióxido de carbono.
Los compuestos se obtienen de fuentes naturales, como las plantas, o se fabrican en laboratorios. Los científicos pueden fabricar compuestos a partir de otros y éstos se denominan productos químicos sintéticos.
La fórmula de los compuestos
Los compuestos se representan mediante fórmulas químicas. Una fórmula química es una forma de expresar información sobre las proporciones de los átomos que constituyen un compuesto químico en particular, utilizando las abreviaturas normalizadas de los elementos químicos y subíndices para indicar el número de átomos involucrados.
- Por ejemplo

El agua se compone de dos átomos de hidrógeno unidos a uno de oxígeno: la fórmula química es H2O (dos átomos de hidrógeno y uno de oxígeno)
|
El orden de los elementos en la fórmula de los compuestos inorgánicos comienza por la izquierda con el elemento menos electronegativo, hasta la derecha con el más electronegativo. Por ejemplo en el NaCl, el cloro que es más electronegativo que el sodio va en la parte derecha. |
La electronegatividad de los elementos

La electronegatividad es una propiedad química que indica la capacidad de un átomo para atraer electrones hacia sí y formar iones negativos. Por lo general, la electronegatividad aumenta desde la parte inferior izquierda a la superior derecha de la tabla periódica.
De esta manera los elementos de fuerte electronegatividad están en la esquina superior derecha de la tabla, o sea, los más cercanos al flúor (F). El flúor tiene una electronegatividad de 3,98 como se puede apreciar en la tabla periódica de los elementos

La electropositividad de los elementos
La electropositividad es una medida de la capacidad de un elemento para donar electrones y formar iones positivos.
Principalmente, se trata de un atributo de los metales. Los metales alcalinos tienen un único electrón en su capa externa y lo pierden fácilmente.
En la tabla periódica de los elementos, los más electropositivos se encuentran en la parte izquierda y hacia abajo de la misma, es decir, en los grupos IA y IIA, siendo los tres elementos más electropositivos el cesio (Cs), el francio (Fr) y el rubidio (Rb).
| Fórmula | Compuesto | Elemento más electronegativo |
|---|---|---|
| H2O | Agua | El hidrógeno tiene una electronegatividad de 2.20, menor que el oxígeno que tiene 3.44 |
| Li2O | Óxido de litio | El litio tiene una electronegatividad de 0.98, menor que el oxígeno que tiene 3.44 |
| ZrH4 | Hidruro de circonio (IV) | El circonio tiene una electronegatividad de 1.33, menor que el hidrógeno que tiene 2.20 |
| AlH3 | Hidruro de aluminio | El aluminio tiene una electronegatividad de 1.61, menor que el hidrógeno que tiene 2.20 |
| Fe2S3 | Sulfuro de hierro(III) | El hierro tiene una electronegatividad de 1.83, menor que el azufre que tiene 2.58 |
- La electronegatividad se puede ver en la tabla periódica de los elementos
Referencias
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
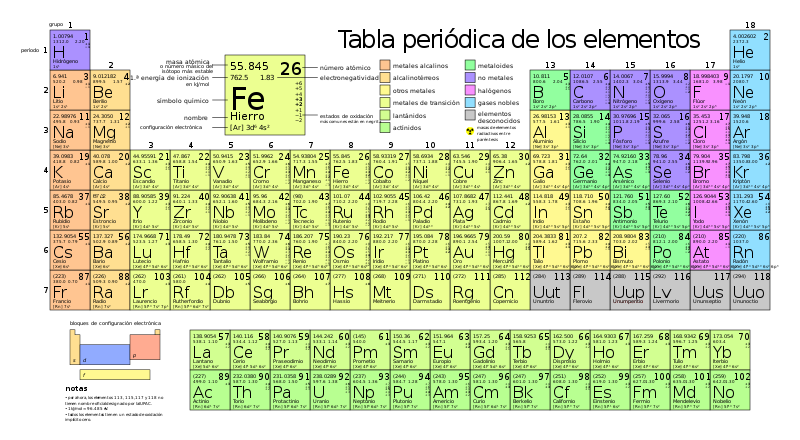
La tabla periódica de los elementos
La tabla periódica de los elementos es una tabla que ordena todos los elementos químicos conocidos. Los elementos que tienen similitudes suelen colocarse cerca unos de otros.
En la tabla, los elementos se colocan en el orden de sus números atómicos empezando por el número más bajo de uno, el hidrógeno.
El número atómico de un elemento es el mismo que el número de protones en ese núcleo concreto de un átomo.
En la tabla periódica, los elementos se ordenan en períodos y grupos.
Período
Una fila de elementos a lo largo de la tabla se denomina período.
- Cada periodo tiene un número, del 1 al 7.
- El período 1 sólo contiene 2 elementos: hidrógeno y helio.
- Los periodos 2 y 3 tienen 8 elementos.
- Otros períodos son más largos.
- Los elementos de un período tienen números atómicos consecutivos. Los protones suelen ser iguales a los electrones.
Grupo
Una columna de elementos en la tabla se denomina grupo.
En la tabla periódica estándar hay 18 grupos. Cada grupo tiene un número: del 1 al 18.
Los elementos de un grupo tienen electrones dispuestos de forma similar, según el número de electrones de valencia, lo que les confiere propiedades químicas similares (se comportan de forma parecida). Por ejemplo, el grupo 18 se conoce como gases nobles porque todos son gases y no se combinan con otros átomos.
- Sistemas de numeración de los grupos
Existen dos sistemas de numeración de los grupos:
- uno con números arábigos (1,2,3)
- y otro con números romanos (I, II, III). Los nombres en números romanos se utilizaron durante la mayor parte del siglo XX.
En 1990, la Unión Internacional de Química Pura y Aplicada (IUPAC) decidió utilizar el nuevo sistema con números arábigos, en sustitución de los dos antiguos sistemas de grupos que utilizaban números romanos.
La tabla periódica ha sido utilizada por los químicos para observar patrones y relaciones entre los elementos.
- Grupos principales en la Tabla Periódica
Existen tres grupos principales en la Tabla Periódica:
- metales
- metaloides
- y no metales
Por ejemplo, los elementos situados en la parte inferior e izquierda de la tabla son los más metálicos y los situados en la parte superior derecha son los menos metálicos. (Por ejemplo, el cesio es mucho más metálico que el helio). También existen muchos otros patrones y relaciones.
La tabla periódica fue inventada por el químico ruso Dmitri Ivánovich Mendeléyev (1834-1907).
Tabla periódica estándar
| Grupos → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| Periodos ↓ | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
*
Lantánidos |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn | ||
| 7 | 87 Fr |
88 Ra |
**
Actínidos |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og | ||
| 8 | 119 Uue |
120 Ubn | ||||||||||||||||||
| * Serie de lantánidos | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||
| ** Serie de actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||
- Series químicas de la Tabla Periódica
- Metales alcalinos
- Alcalinotérreos
- Lantánidos
- Actínidos
- Metales de transición
- Otros metales
- Metaloides
- No metales
- Halógenos
- Gases nobles
- Estado a temperatura y presión estándar. El color del número (número atómico) sobre el símbolo del elemento muestra el estado del elemento en condiciones normales.
- aquellos que están en azul son gases
- aquellos que están en verde son líquidos
- aquellos que están en negro son sólidos
- Radioactividad
- Los que tienen bordes sólidos tienen isótopos estables (Elementos primordiales)
- Los que tienen bordes discontinuos sólo tienen isótopos radiactivos naturales
- Los que tienen bordes punteados no se dan de forma natural (Elementos sintéticos)
- Los que no tienen bordes son demasiado radiactivos para haber sido descubiertos todavía.
Isótopos

Los átomos de un elemento químico pueden existir en diferentes tipos. Estos se llaman isótopos. Tienen el mismo número de protones (y electrones), pero diferentes números de neutrones.
Debido a que diferentes isótopos tienen diferentes números de neutrones, no todos pesan lo mismo ni tienen la misma masa.
Diferentes isótopos del mismo elemento tienen el mismo número atómico que es el número de protones.[1] Los isótopos tienen diferentes números de masa o masa atómica, sin embargo, porque tienen diferentes números de neutrones.
La palabra isótopo, que significa en el mismo lugar, proviene del hecho de que los isótopos están en el mismo lugar en la tabla periódica.
En un átomo neutro, el número de electrones es igual al número de protones. Los isótopos del mismo elemento también tienen el mismo número de electrones y la estructura electrónica. Debido a que la forma en que actúa un átomo se decide por su estructura electrónica, los isótopos son casi iguales químicamente, pero diferentes físicamente a sus átomos originales.

|
Masa atómica: La masa atómica de un elemento es la suma de la masa de sus protones y neutrones, también se conoce como número másico o peso atómico y está indicado en la tabla periódica de los elementos. En el caso del hidrógeno que está en la imagen el peso atómico es de 1.00794 |
Estabilidad
Algunos isótopos son radioactivos y se llaman isótopos radioactivos. Otros no son radioactivos y se llaman isótopos estables.
El hidrógeno tiene tres isótopos comunes. (imagen)
- El isótopo más común del hidrógeno se llama protio (1H). (a la izquierda en la imagen)
- Un átomo de hidrógeno con un neutrón (número de masa 2) se llama deuterio (2H).
- El hidrógeno con un protón y dos neutrones (número de masa 3) se llama tritio (3H).[2]
El protio y el deuterio son isótopos estables, mientras que el tritio es un isótopo radioactivo.
En la naturaleza el hidrógeno está compuesto en su mayoría por protio; el deuterio se encuentra en partes muy pequeñas y el tritio es más escaso aún porque es radiactivo y se descompone rápidamente para formar otro elemento distinto, el helio.
Los elementos más pesados de la tabla periódica son todos radioactivos. Todos los isótopos del radón, torio y uranio son radioactivos, ya que son muy pesados. Esto se debe a que las fuerzas nucleares dentro del núcleo del átomo tienen dificultades para mantener juntas todas las partículas con tantos protones y neutrones en su interior.
Referencias
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
La tabla periódica de los elementos: Actividades
1º.- Relaciona cada elemento con su símbolo
Hidrógeno Litio Carbono Azufre Arsénico Plomo Cobre |
Cu Li S C As Pb H |
Cobalto Níquel Plata Paladio Rutenio Zinc Cadmio |
Ag Ru Zn Pd Cd Co Ni |
2º.- Dados los siguientes elementos, completa en tu cuaderno la tabla siguiente
| Elemento | Nombre | nº másico | nº atómico | nº de protones | nº de electrones | nº de neutrones |
|---|---|---|---|---|---|---|
| K | ||||||
| Na | ||||||
| N | ||||||
| Br | ||||||
| Ni | ||||||
| S | ||||||
| Ne |
3º.- Los números atómicos de los elementos A, B, C, D, E y F son respectivamente 31, 77, 57, 3, 20 y 36. Indica de que elementos se trata y en que grupo y período se encuadran
4º.- Rellena la tabla periódica con los símbolos de los elementos, sus nombres, su número atómico y su masa atómica

-------------------------------------------------------------------------------------------------------------------
El enlace químico
Enlace entre átomos para formar moléculas

Para que exista una molécula, los átomos tienen que unirse (enlazarse). Esto ocurre cuando dos átomos comparten electrones. En lugar de girar alrededor de un solo átomo, el electrón gira ahora alrededor de dos. A veces, comparten más de un electrón. Cuantos más electrones se compartan, más fuerte será el enlace y más se pegarán los átomos.
El enlace entre átomos también ocurre cuando un átomo de un elemento cede uno o más electrones a otro átomo.[1]
Capa electrónica
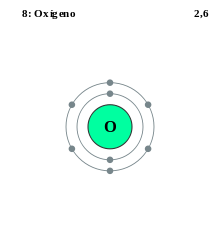
Estructura de las capas de electrones del oxígeno (dos electrones en la primera capa y 6 en la segunda, ocho en total)
Una capa electrónica, capa de electrones o cubierta de electrones designa a la distribución de un orbital alrededor del núcleo de un átomo. Cada capa puede contener un cierto número máximo de electrones.
En un átomo estable, para que una cierta capa pueda contener o donar electrones, es necesario que todas las anteriores a ella estén completamente ocupadas. Los electrones en la capa poblada más externa, llamada capa de valencia y que es la única que puede encontrarse parcialmente vacía, determinan las propiedades químicas del átomo.
Cada capa puede contener solo un número fijo de electrones:
- la primera capa puede contener hasta dos electrones,
- la segunda capa puede contener hasta ocho (2 + 6) electrones,
- la tercera capa puede contener hasta dieciocho (2 + 6 + 10) y así.
- La fórmula general es que la capa n puede, en principio, contener hasta 2 (n2) electrones.
Teoría del octeto
La teoría del octeto dice que los iones de los elementos del sistema periódico tienen la tendencia a completar sus últimos niveles de energía con una cantidad de 8 electrones, de tal forma que adquieren una configuración muy estable.

Cada átomo de oxígeno tiene seis electrones en su capa de valencia. Al compartir dos de sus electrones con otro átomo de oxígeno, cada átomo de oxígeno "tiene" ocho electrones en su capa de valencia. Así, los cuatro electrones que se encuentran entre los átomos de oxígeno son "poseídos" por ambos átomos.
Esta configuración es semejante a la de un gas noble, los elementos ubicados al extremo derecho de la tabla periódica.
Los gases nobles son elementos electroquímicamente estables, ya que son inertes, es decir que es muy difícil que reaccionen con algún otro elemento.
Enlace en la molécula de oxígeno (enlace covalente)

La molécula del gas oxígeno (dioxígeno) está formada por dos átomos del elemento oxígeno que como hemos visto en la (imagen 1) tiene seis electrones en su última capa (capa de valencia).
Según la regla del octeto el átomo de oxígeno tiende a rellenar los dos electrones que le faltan para parecerse al gas noble que tiene ocho electrones en su última capa.
Entonces se forma un enlace con otro átomo de oxígeno igual y comparte dos de sus electrones de su última capa con el otro átomo. Así los dos átomos se enlazan, forman una molécula de gas oxígeno y quedan estables al tener completa su ultima capa. (figuras 2 y 3)
Otro tipo de enlace (enlace iónico)

Enlace iónico

b) Las cargas eléctricas opuestas del catión de sodio y del anión cloruro resultantes dan lugar a la formación de un enlace de atracción llamado enlace iónico.
c) La atracción de muchos iones de sodio y de cloruro da lugar a la formación del ClNa en grandes agrupaciones llamadas cristales.
El enlace iónico es un tipo de enlace químico que implica la atracción electrostática entre iones de carga opuesta. Los iones son átomos (o grupos de átomos) con carga electrostática. Los átomos que ganan electrones forman iones con carga negativa. Los átomos que pierden electrones forman iones con carga positiva.
- Descripción general
Los átomos que tienen una capa de valencia casi llena o casi vacía tienden a ser muy reactivos y frecuentemente se enlazan con otros átomos. Los enlaces iónicos se consideran entre los más fuertes de todos los tipos de enlaces químicos. Esto hace que los compuestos iónicos sean muy estables.
- Formación
En el ejemplo de la figura 4 se observa que el átomo de sodio pierde su electrón exterior para darle una configuración electrónica estable (ocho electrones en su segunda capa), y este electrón entra en el átomo de flúor (que tiene siete electrones en su capa segunda capa) y así completa los ocho que necesita para ser estable y formar el compuesto fluoruro de sodio.
Sodio + Fluor = Fuoruro de sodio
Los enlaces se pueden romper
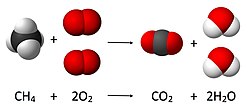
Los enlaces también pueden romperse. Como la mayoría de los enlaces necesitan energía para formarse, también desprenden energía cuando se rompen. Pero antes de que la mayoría de los enlaces se rompan, la molécula tiene que calentarse. Entonces, los átomos empiezan a moverse y, cuando se mueven demasiado, el enlace se rompe.
Las moléculas que necesitan menos energía para romperse de la que desprenden cuando se rompen se llaman combustibles.
|
Un ejemplo de un combustible |
Referencias
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Reacciones químicas

Una reacción química se produce cuando una o varias sustancias químicas se transforman en otra u otras.
Las sustancias que intervienen en la reacción se llaman reactivos y la sustancia o sustancias resultantes se llaman productos.
Ejemplos
|
- el aluminio y el oxígeno se combinan para formar óxido de aluminio Esta es una ecuación química que se leería: cuatro moléculas de aluminio más tres de oxígeno producen dos moléculas de óxido de aluminio |
|
- el vinagre y el bicarbonato de sodio se combinan para formar acetato de sodio, agua y dióxido de carbono Esta ecuación química se leería: una moléculas de vinagre más una de bicarbonato de sodio producen una molécula de acetato de sodio más una de agua y una de dióxido de carbono |
|
- cosas que arden o explotan
Esta ecuación química se leería: una moléculas de carbono más una de oxígeno producen una molécula de dióxido de carbono más calor |
|
- muchas reacciones que ocurren en el interior de los seres vivos, como la fotosíntesis Esta ecuación química se leería: seis moléculas de dióxido de carbono más 6 de agua producen una molécula de glucosa más seis de oxígeno. |
|
- reacciones electroquímicas al descargar o recargar pilas Esta ecuación química se leería: un átomo de zinc más dos moléculas de óxido de hidróxido de níquel más una de agua producen una molécula de óxido de zinc más dos de hidróxido de níquel. |

- Algunas reacciones son rápidas y otras lentas. Algunas ocurren a diferentes velocidades, dependiendo de la temperatura o de otras cosas. Por ejemplo, la madera no reacciona con el aire cuando está fría, pero si se calienta lo suficiente, empieza a arder.
- Algunas reacciones desprenden energía. Son reacciones exotérmicas. En otras reacciones se absorbe energía. Son reacciones endotérmicas.
- Las reacciones nucleares no son reacciones químicas. En las reacciones químicas sólo intervienen los electrones de los átomos, mientras que en las reacciones nucleares intervienen los protones y neutrones de los núcleos atómicos.
Cuatro tipos básicos de reacciones

Síntesis

En una reacción de síntesis, dos o más sustancias simples se combinan para formar una sustancia más compleja.
"Dos o más reactantes que dan un producto" es otra forma de identificar una reacción de síntesis. Un ejemplo de reacción de síntesis es la combinación de hierro y azufre para formar sulfuro de hierro:
Otro ejemplo es el gas hidrógeno simple combinado con gas oxígeno simple para producir una sustancia más compleja, como el agua.[1]
Descomposición


Una reacción de descomposición se produce cuando una sustancia más compleja se descompone en sus partes más simples. Es, por tanto, lo opuesto a una reacción de síntesis, y puede escribirse como:[1][2]
Un ejemplo de reacción de descomposición es la electrólisis del agua para obtener oxígeno e hidrógeno gaseosos:
Otro ejemplo de reacción de descomposición es el carbonato de calcio que se descompone en óxido de calcio y dióxido de carbono a altas temperaturas:
Sustitución simple

En una reacción de sustitución simple, un solo elemento no combinado sustituye a otro en un compuesto; en otras palabras, un elemento intercambia su lugar con otro elemento en un compuesto[1] Estas reacciones se presentan en la forma general de:
Un ejemplo de reacción de desplazamiento simple es cuando el magnesio sustituye al hidrógeno en el agua para producir hidróxido de magnesio y gas hidrógeno:
Doble sustitución

En una reacción de doble sustitución, dos compuestos cambian de lugar y forman dos compuestos completamente diferentes.[1] Estas reacciones tienen la forma general:[2]
Por ejemplo, cuando reaccionan cloruro de bario (BaCl2) y sulfato de magnesio (MgSO4), el SO cambia de lugar con el Cl, dando los compuestos BaSO4 y MgCl2.
Ecuaciones
Una reacción química se muestra mediante una ecuación:
- Aquí, A y B reaccionan produciendo C y D en una reacción química.
Una ecuación química consiste en una lista de reactivos (las sustancias de partida) en el lado izquierdo, una símbolo de flecha, y una lista de productos (sustancias formadas en la reacción química) en el lado derecho.

Como ejemplo, la ecuación para la reacción de ácido clorhídrico con sodio puede denotarse:
Esta ecuación podría leerse como "dos H-C-L más dos N-A producen dos N-A-C-L y dos H". También se puede decir en esta ecuación que "dos moléculas de ácido clorhídrico y dos átomos de sodio reaccionan para formar dos moléculas de cloruro de sodio y una molécula de gas hidrógeno."
Referencias
- ↑ 1,0 1,1 1,2 1,3 ¿Reaccionar o no reaccionar? archivo Oficina de educación del estado de Utah. Recuperado el 4 de junio de 2011
- ↑ 2,0 2,1 Seis tipos de reacciones químicas - MrGuch ChemFiesta.
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Las mezclas

En química, una mezcla es una sustancia que se compone de dos o más sustancias más simples. Estas sustancias pueden ser elementos químicos o compuestos.[1] Una mezcla puede estar formada por líquidos, sólidos o gases.
Diferencia entre mezcla u compuesto
Una mezcla no es lo mismo que un compuesto, porque un compuesto está formado por dos o más clases de átomos conectados entre sí. Por ejemplo, una mezcla de los gases hidrógeno y nitrógeno contiene hidrógeno y nitrógeno, no el compuesto llamado amoníaco (NH3), que está formado por átomos de hidrógeno y nitrógeno unidos químicamente.
Clasificación de las mezclas

- homogénea: una mezcla donde los componentes no se pueden distinguir uno de otro
- heterogénea: es una mezcla donde las diferentes partes se pueden distinguir fácilmente y
Disoluciones

Si en una mezcla, una sustancia se disuelve en la otra, se llama una disolución. Por ejemplo, si al agua se le añade azúcar, se forma una mezcla, luego el azúcar se disuelve y entonces forma una disolución, también llamada solución. Si la sustancia no se disuelve, la mezcla se llama una suspensión.
- Disolvente
En las disoluciones el disolvente o solvente es una sustancia que disuelve al soluto (un sólido, líquido o gas químicamente diferente), resultando en una disolución; normalmente el solvente es el componente de una disolución presente en mayor cantidad.
- Soluto
En las disoluciones el soluto es una sustancia que se disuelve en un disolvente, es decir, que se combina con otra sustancia, que es el disolvente. Lo más habitual es que se trate de un sólido en un disolvente líquido, lo que origina una disolución líquida.
- Solubilidad

La solubilidad es la capacidad de una sustancia de disolverse en otra llamada disolvente. Si una sustancia se puede disolver en otra se dice que es soluble en ella.
Por ejemplo el azúcar es soluble en agua, pero el aceite no es soluble en agua.
¿Qué es la concentración?
La concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolución o de disolvente. Si hay poco soluto y mucho disolvente la concentración será diluida, si hay mucho soluto y el mismo disolvente o menos, entonces es una disolución concentrada.
Aleaciones
Los sólidos también pueden ser mezclas. Las aleaciones son mezclas. Muchos tipos de rocas son mezclas de diferentes minerales. Por lo tanto, una mezcla está formada de dos o más elementos y/o compuestos que no se combinan químicamente.
Las aleaciones están formadas por dos o más elementos químicos, de los cuales al menos uno es un metal. Una aleación tiene propiedades diferentes de los metales que la componen.
Fabricación
La mayoría de las aleaciones se fabrican fundiendo los metales, mezclándolos en estado líquido para formar una solución y dejándolos enfriar para que vuelvan a solidificarse.
Historia

La primera aleación descubierta fue el bronce. El bronce está hecho de cobre y estaño. El bronce se descubrió hace mucho tiempo, en la prehistoria. Entonces, el bronce se utilizaba para fabricar herramientas y armas. Este periodo se conoció como la Edad de Bronce. Pero más tarde se descubrieron aleaciones mejores que sustituyeron al bronce para fabricar herramientas y armas. En la actualidad, el bronce se utiliza para fabricar adornos, estatuas y campanas.
Algunas aleaciones comunes

Existen algunas aleaciones comunes:
- El latón está compuesto por un 35% de zinc y un 65% de cobre y se utiliza para instrumentos musicales, joyería, grifería y herrajes decorativos.
- El acero inoxidable se compone principalmente de hierro, más de un 11% de cromo y diversas cantidades de níquel y carbono, y se utiliza para vajillas, utensilios de cocina y herramientas quirúrgicas.
- El acero se compone de un 99% de hierro y un 1% de carbono y se utiliza para herramientas, carrocerías de automóviles, maquinaria, vigas y raíles.
- El bronce se compone principalmente de cobre y algo de estaño, y se utiliza para herrajes de barcos, tornillos y parrillas.
- El alnico es una mezcla de aluminio, níquel y cobalto, y se utiliza para fabricar imanes permanentes.
Referencias
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Clasificación de los compuestos químicos
Los compuestos químicos se clasifican en dos grandes grupos:
- Compuestos inorgánicos
- Compuestos orgánicos
Compuestos inorgánicos

- Óxidos básicos. También llamados óxidos metálicos, que están formados por un metal y oxígeno. Ejemplos: el óxido de plomo (PbO), el óxido de litio (Li2O).
- Óxidos ácidos. También llamados óxidos no metálicos, formados por un no metal y oxígeno. Ejemplos: monóxido de dicloro (CL2O), monóxido de selenio (SeO).
- Hidruros, que pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento e hidrógeno. Ejemplos: hidruro de aluminio (AlH), hidruro de sodio (NaH).
- Hidrácidos, son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el yoduro de hidrógeno (HI).
- Hidróxidos, compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio (NaOH), o sosa cáustica.
- Oxácidos, compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo, ácido oxoclórico (I) (HClO).
- Sales binarias, compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio (NaCl).
- Oxisales, formadas por la reacción de un oxácido y un hidróxido, como por ejemplo el hipoclorito de sodio (NaClO).
Compuestos orgánicos

- Compuestos alifáticos, son compuestos orgánicos constituidos por carbono e hidrógeno cuyo carácter no es aromático.
- Compuestos aromáticos, es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π.
- Compuestos heterocíclicos, son compuestos orgánicos cíclicos en los que al menos uno de los componentes del ciclo es de un elemento diferente al carbono.
- Compuestos organometálicos, es un compuesto en el que los átomos de carbono forman enlaces covalentes, es decir, comparten electrones, con un átomo metálico.
- Polímeros, son macromoléculas formadas por la unión de moléculas más pequeñas llamadas monómeros.
Molécula


Una molécula es un grupo de átomos unidos de una forma definida por enlaces químicos, y que pueden permanecer unidos por sí mismos. Las moléculas son la parte más pequeña que puede formar un compuesto químico.
Clasificación
Según la clase de átomos que las forman
Las moléculas pueden componerse de átomos de un solo elemento, se llaman homonucleares (por ejemplo, el oxígeno del aire, O2), o de varios, se llaman heteronucleares (por ejemplo, la molécula del agua H2O).
Actualmente se conocen millones de moléculas, la mayoría son compuestos del carbono.
Según la cantidad de átomos que se integren en su estructura
- Moléculas monoatómicas. Integradas por un solo átomo. Por ejemplo: el helio (He).
- Moléculas diatómicas. Integradas por dos átomos. Por ejemplo: el oxígeno molecular (O2).
- Moléculas triatómicas. Integradas por tres átomos. Por ejemplo: el agua (H2O).
- Moléculas tetraatómicas. Integradas por cuatro átomos. Por ejemplo: el amoníaco (NH3), y así sucesivamente.
- También se pueden llamar poliatómicas a las que tienen tres o más átomos: (H2O), (NH3), el metano (CH4)
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Formulación de los compuestos
Para formular los compuestos inorgánicos hay que conocer los símbolos y los números de oxidación de los elementos que forman el compuesto
El orden de los elementos en la fórmula de los compuestos inorgánicos comienza por la izquierda con el elemento menos electronegativo, hasta la derecha con el más electronegativo. A continuación se intercambian los números de oxidación, sin signo, colocándolos como subíndices y simplificándolos, si es posible, teniendo en cuenta que el subíndice 1 se omite.
| Número de oxidación |
Elemento | Número de oxidación |
Elemento |
|---|---|---|---|
| +1 | Hidrógeno (H), Litio (Li), Sodio (Na), Potasio (K), Plata (Ag) |
-1 | Hidrógeno (H), Flúor (F) |
| +2 | Berilio (Be), Magnesio (Mg), Calcio (Ca), Bario (Ba), Zinc (Zn) |
-1, +1, +3, +5, +7 |
Cloro (Cl), Bromo (Br), Yodo (I) |
| +3 | Aluminio (Al) | -2 | Oxígeno (O) |
| +1, +2 | Cobre (Cu), Mercurio (Hg) | -2, +2, +4, +6 |
Azufre (S), Selenio (Se), Teluro (Te) |
| +1, +3 | Oro (Au) | -3, +3 | Boro (B) |
| +2, +3 | Cromo (Cr), Manganeso (Mn), Hierro (Fe), Cobalto (Co), Níquel (Ni), |
-3, +1, +3, +5 |
Nitrógeno (N), Fósforo (P), Arsénico (As), Antimonio (Sb) |
| +2, +4 | Estaño (Sn), Plomo (Pb), Platino (Pt) |
-4, +4 | Carbono (C), Silicio (Si) |
Regla de los números de oxidación en los compuestos
En un compuesto, la suma de los números de oxidación de sus elementos es igual 0. Al hacer la suma se debe multiplicar el número de oxidación del elemento por el subíndice que pudiese tener en la fórmula del compuesto.
- Ejemplo:
En el ácido sulfúrico, cuya fórmula es , los números de oxidación de los elementos que lo forman son: , ; , y ,
- Su suma es:
- 2 (+1) + 6 + 4 (-2) = 2 + 6 - 8 = 8 - 8 = 0

Escribir la fórmula del dióxido de carbono
- El dióxido de carbono esta formado por oxígeno (óxido) (O) y carbono (C).
- Escribimos primero la fórmula del elemento carbono (C) por ser el menos electronegativo con su número de oxidación entre paréntesis.
- A continuación hacemos lo mismo con el oxígeno.
- Escribimos los dos elementos juntos con los números de oxidación intercambiados, como subíndices
- Simplificamos los subíndices dividiendo por 2 ambos y nos queda la fórmula CO2
- El carbono queda con el subíndice 1 después de simplificar pero el 1 se omite.
- C (+4) y O (-2) C2O4 CO2
Los números de oxidación son:,; ,
Se cumple la regla anterior en la fórmula
- Su suma es:
- 4 + 2 (-2) = 4 - 4 = 0

Escribir la fórmula del trióxido de dihierro
- El trióxido de dihierro esta formado por oxígeno (óxido) (O) y hierro (Fe).
- Escribimos primero la fórmula del elemento hierro (Fe) por ser el menos electronegativo con su número de oxidación entre paréntesis.
- A continuación hacemos lo mismo con el oxígeno.
- Escribimos los dos elementos juntos con los números de oxidación intercambiados, como subíndices.
Los números de oxidación son:,; ,
Se cumple la regla anterior en la fórmula
- Su suma es:
- 2 3 + 3 (-2) = 6 - 6 = 0
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Óxidos
Los óxidos son compuestos binarios formados por la combinación del oxígeno con un elemento químico.
Formulación
1.- El oxígeno actúa con su número de oxidación o valencia (-2), mientras el otro elemento actúa con un número de oxidación positivo.
2.- La fórmula se obtiene al intercambiar los números de oxidación de dichos elementos. El subíndice 1 no se escribe.
3.- Si ambos subíndices tienen un divisor común se simplifican
|
Donde:
|
Ejercicios resueltos:

Formular el óxido de hierro con estado de oxidación +3
1.- Escribimos primero el símbolo del hierro y, a continuación, el símbolo del oxígeno
2.- Intercambiamos sus números de oxidación en forma de subíndices: el -2 del oxígeno se pone, sin signo, como subíndice del hierro y el +3 del hierro se coloca, sin signo, como subíndice del oxígeno
3.- La fórmula del óxido es Fe2O3

Formular el óxido de hierro con estado de oxidación +2
1.- Escribimos primero el símbolo del hierro y, a continuación, el símbolo del oxígeno
2.- Intercambiamos sus números de oxidación en forma de subíndices: el -2 del oxígeno se pone, sin signo, como subíndice del hierro y el +2 del hierro se coloca, sin signo, como subíndice del oxígeno
4.- Se simplifican los índices dividiendo por el divisor común 2 y nos da 1, que no se pone
3.- La fórmula del óxido es Fe O
Nomenclatura
Las nomenclaturas más utilizadas son la estequiométrica y la de Stock, aunque también existe la tradicional pero está en desuso.
Estequiométrica
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido precedido del prefijo numérico que le corresponde, debido a la cantidad de átomos que hay en el compuesto de dicho elemento, y para el elemento, su nombre precedido también por el prefijo numérico que le corresponde, unidos los dos elementos por la partícula "de".
Los prefijos son:
|
|
|
|
Ejemplos:
|
|
|
Aclaración:
|
Stock
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido, pero no se le precede de ningún prefijo, después se sitúa la partícula "de" y a continuación se pone el nombre del elemento, seguido, si es necesario, de su valencia en números romanos. Si dicho elemento no tiene más que una sola valencia, no es necesario ponerlo.
Ejemplos:
|
(simplificación de S2O6 al dividir por 2 los subíndices)
|
- Excepción: El oxígeno no forma óxido con el flúor, ya que éste es más electronegativo.
Ejemplo de reacción para formar el dióxido de carbono

Un átomo de carbono que tiene cuatro electrones en su última capa reacciona con una molécula de oxígeno formada por dos átomos unidos por un enlace covalente con el que comparten dos electrones que les faltan para tener ocho en su última capa.
Al unirse el átomo de carbono con cada uno de los átomos de oxígeno comparte dos electrones (negros en la imagen) con cada uno de los átomos de oxígeno y así tanto los átomos de oxígeno alcanzan los ocho electrones en su última capa, como el átomo con sus cuatro electrones compartidos también alcanza los ocho electrones en su última capa.
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Óxidos: Actividades
1º.- Completa la tabla
| Óxido | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
Óxido | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
| Li2 O | Óxido de litio | Óxido de litio | Ti O | Monóxido de titanio | Óxido de titanio(II) |
| Be O | Ti O2 | Dióxido de titanio | Óxido de titanio(IV) | ||
| Na2 O | Ti2 O3 | ||||
| Mg O | V O | Monóxido de vanadio | Óxido de vanadio(II) | ||
| K2 O | V2 O3 | ||||
| Ca O | V O2 | ||||
| Rb2 O | V2 O5 | ||||
| Sr O | Cr O | ||||
| Cs2 O | Cr2 O3 | ||||
| Ba O | Cr O2 | Óxido de cromo(IV) | |||
| Ra O | Cr O3 | ||||
| Sc2 O3 | Trióxido de diescandio | Óxido de escandio(III) | Rh2 O3 | ||
| Y2 O3 | Óxido de itrio(III) | Pt O2 | Dióxido de platino |
2º.- Escribe la fórmula de los óxidos y completa
| Óxido | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
Óxido | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
| Monóxido de zinc | Óxido de zinc | Trióxido de diarsénico | |||
| Óxido de plata(I) | Pentaóxido de diarsénico | ||||
| Trióxido de dialuminio | Óxido de antimonio(III) | ||||
| Óxido de carbono (II) | Pentaóxido de diantimonio | ||||
| Dióxido de carbono | Pentaóxido de dibismuto | ||||
| Monóxido de estaño | Óxido de bismuto(II) | ||||
| Óxido de estaño(IV) | Óxido de azufre(II) | ||||
| Trióxido de dinitrógeno | Óxido de azufre(VI) | ||||
| Monóxido de nitrógeno | Dióxido de azufre | ||||
| Óxido de nitrógeno(I) | Monóxido de selenio | ||||
| Pentaóxido de dinitrógeno | Dióxido de selenio | ||||
| Óxido de nitrógeno(IV) | Óxido de selenio(VI) | ||||
| Óxido de fósforo(V) | Heptaóxido de dicloro |
-----------------------------------------------------------------------------------------------------------------------------------------------------
- 3º.- Escribe la fórmula de los óxidos
- 4º.- Escribe el nombre de los óxidos
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Hidruros
Hidruros (compuestos binarios con hidrógeno)
Los hidruros son compuestos binarios formados por hidrógeno y otro elemento.
Hidruros metálicos
- Son compuestos binarios o diatómicos formados por hidrógeno y un metal. En estos compuestos, el hidrógeno siempre tiene como número de oxidación -1.[1]
- Se nombran con la palabra hidruro (por el hidrógeno) y a continuación la palabra de, seguida del nombre del otro elemento (hidruro de nombre del otro elemento)
- Su fórmula general es Metal + H.
Metal + Hidrógeno → Hidruro metálico
Para nombrar estos compuestos en las nomenclaturas Stock y sistemática se utilizan las reglas generales con la palabra hidruro como nombre genérico.
Se indicará la proporción de los elementos con los correspondientes prefijos multiplicadores (mono, di, tri, tetra, penta, hexa, epta, octa) o el número de oxidación ( I, II, III, IV, V, Vi, VII ), como en los ejemplos
| Compuesto | Nomenc. sistemática | Nomenc. Stock |
|---|---|---|
| KH | monohidruro de potasio | hidruro de potasio |
| NiH3 | trihidruro de níquel | hidruro de níquel(III) |
| PbH4 | tetrahidruro de plomo | hidruro de plomo(IV) |
| NaH | monohidruro de sodio | hidruro de sodio |
| CaH2 | dihidruro de calcio | hidruro de calcio |
| AlH3 | trihidruro de aluminio | hidruro de aluminio |
| FeH2 | dihidruro de hierro | hidruro de hierro (II) |
| FeH3 | trihidruro de hierro | hidruro de hierro (III) |
| MgH | monohidruro de magnesio | hidruro de magnesio (I) |
| MgH2 | dihidruro de magnesio | hidruro de magnesio (II) |
- Nota: En la nomenclatura Stock del hidruro de potasio no se pone el número de oxidación del potasio porque solo tiene un número de oxidación. No sería correcto escribir hidruro de potasio(I), igual con los hidruros de sodio, calcio y aluminio.

Formular el hidruro de potasio con estado de oxidación +1
1.- Escribimos primero el símbolo del potasio y, a continuación, el símbolo del hidrógeno
2.- Intercambiamos sus números de oxidación en forma de subíndices: el -1 del hidrógeno se pone, sin signo, como subíndice del potasio y el +1 del potasio se coloca, sin signo, como subíndice del hidrógeno
3.- Al tener los subíndices 1 se omiten estos.
3.- La fórmula del hidruro de potasio es KH
Hidruros no metálicos o hidrácidos
Los hidruros no metálicos se nombran agregando al no metal el sufijo -uro y la palabra hidrógeno precedido de la sílaba “de”.
Se formulan escribiendo primero el símbolo del hidrógeno y después el del elemento. A continuación se intercambian los números de oxidación. El hidrógeno actúa con su número de oxidación positivo (+1) y se combina con los elementos no metales del grupo 17 (flúor, cloro, bromo y yodo con número de oxidación (-1), y con los elementos no metales del grupo 16 (azufre, selenio y telurio con número de oxidación (–2).[2]
- Ejemplo 1º
- (gas) bromuro de hidrógeno,
bromuro como nombre específico e hidrógeno como nombre genérico.
|
|
- Ejemplo 2º
- (gas) sulfuro de hidrógeno,
sulfuro como nombre específico e hidrógeno como nombre genérico.
Hidrácidos
Los hidrácidos provienen de disolver en agua a los hidruros no metálicos. Se nombran con la palabra ácido, como nombre genérico, y como nombre específico se escribe el nombre del no metal y se le agrega el sufijo –hídrico.
| Compuesto | en estado puro | en disolución |
|---|---|---|
| HCl | cloruro de hidrógeno | ácido clorhídrico |
| HF | fluoruro de hidrógeno | ácido fluorhídrico |
| HBr | bromuro de hidrógeno | ácido bromhídrico |
| HI | yoduro de hidrógeno | ácido yodhídrico |
| H2S | sulfuro de hidrógeno | ácido sulfhídrico |
| H2Se | seleniuro de hidrógeno | ácido selenhídrico |
| H2Te | teluluro de hidrógeno | ácido telurhídrico |

Hidruros especiales
Los hidruros especiales son combinaciones de hidrógeno junto a uno de los siguientes elementos: N, P, As, Sb, C, Si y B. Todos ellos actúan con número de oxidación 3 salvo el C y el Si que actúan con número de oxidación 4. También se llaman progenitores porque pueden dar lugar a otros compuestos al sustituir sus átomos de hidrógeno por otros átomos o grupos sustituyentes.
- Nomenclatura tradicional: los hidruros especiales pueden ser llamados utilizando nombres propios que los identifican.[3]
Ejemplos
| NH3 | Amoniaco |
| PH3 | Fosfina |
| AsH3 | Arsina |
| SbH3 | Estibina |
| BH3 | Borano |
| CH4 | Metano |
| SiH4 | Silano |
- Nomenclatura sistemática: la nomenclatura sistemática de los hidruros volátiles se nombra utilizando los prefijos numéricos: mono-, di-, tri-, tetra-, etc.
Ejemplos:
| NH3 | trihidruro de nitrógeno |
| CH4 | tetrahidruro de carbono |
Referencias
- ↑ Química 1 - Página 145
- ↑ Diversificación II Ámbito Científico-Tecnológico (Edición 2012) pág. 57, en Google libros
- ↑ Formulación química
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Hidruros: Actividades
1º.- Completar
2º.- Completa la tabla
| Hidruro | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
Hidruro | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
| KH | monohidruro de potasio | hidruro de potasio | MgH2 | ||
| NiH3 | VH2 | ||||
| PbH4 | VH3 | ||||
| NaH | VH5 | ||||
| CaH2 | VH2 | ||||
| AlH3 | TiH3 | ||||
| MgH | TiH4 | ||||
| FeH2 | RhH6 | ||||
| FeH3 | HgH |
3º.- Escribe la fórmula de los hidruros y completa
| Hidruro | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
Hidruro | Nomenclatura
estequiométrica |
Nomenclatura
Stock |
| hidruro de zinc | monohidruro de mercurio | ||||
| hidruro de plata | hidruro de plomo(IV) | ||||
| trihidruro de aluminio | hexahidruro de rodio | ||||
| dihidruro de estaño | hidruro de titanio(IV) | ||||
| hidruro de estaño(IV) | pentahidruro de vanadio | ||||
| hidruro de magnesio(I) | hidruro de níquel(III) |
4º.- Completar
5º.- Completar
| Hidruro no metálico | |
|---|---|
| HCl | cloruro de hidrógeno |
| fluoruro de hidrógeno | |
| bromuro de hidrógeno | |
| yoduro de hidrógeno | |
| sulfuro de hidrógeno | |
| seleniuro de hidrógeno | |
| teluluro de hidrógeno | |
6º.- Completar
7º.- Completar
| Compuesto | en estado puro | en disolución |
|---|---|---|
| HCl | cloruro de hidrógeno | |
| HF | ácido fluorhídrico | |
| bromuro de hidrógeno | ||
| yoduro de hidrógeno | ||
| ácido sulfhídrico | ||
| ácido selenhídrico | ||
| teluluro de hidrógeno |
8º.- Completar
9º.- Completar
| NH3 | |
| PH3 | |
| Arsina | |
| Estibina | |
| BH3 | |
| Metano | |
| SiH4 |
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Hidróxidos
Hidróxidos o bases (compuestos ternarios básicos)
Los hidróxidos son compuestos ternarios (formados por tres clases de átomos) básicos formados por la unión de un óxido básico con agua. Se caracterizan por tener en solución acuosa el radical o grupo oxhidrilo o hidroxilo OH-1.
- Para nombrarlos se escribe con la palabra genérica hidróxido, seguida del nombre del metal electropositivo, según las reglas generales de la nomenclatura sistemática o la nomenclatura Stock.
La fórmula general es:
- Metal + (OH)-1x
- Para formularlos se escribe el metal y luego el grupo funcional OH, (ion hidróxido, OH-), denominado grupo hidroxilo, que actúa con número de oxidación -1. A este oxidrilo se le coloca de subíndice, si el metal tiene número de oxidación superior a 1, se le pone entre paréntesis: (OH), y se coloca por subíndice, el número de oxidación del metal. Luego se balancea.
.....................................................................................................................................................
Na2O + H2O → 2Na(OH)
Óxido de sodio + Agua → Hidróxido de sodio| Compuesto | Nomenclatura sistemática | Nomenclatura Stock |
|---|---|---|
| Na(OH) | hidróxido de sodio | hidróxido de sodio |
| Li(OH) | hidróxido de litio | hidróxido de litio |
| Pb(OH)2 | dihidróxido de plomo | hidróxido de plomo (II) |
| Al(OH)3 | trihidróxido de aluminio | hidróxido de aluminio (III) |
| Al(OH) | monohidróxido de aluminio | hidróxido de aluminio (I) |
| Cu(OH)2 | dihidróxido de cobre | hidróxido de cobre(II) |
| Pb(OH)4 | tetrahidróxido de plomo | hidróxido de plomo (IV) |
| K(OH) | hidróxido de potasio | hidróxido de potasio |
| Zn(OH)2 | dihidróxido de zinc | hidróxido de zinc |
| Hg(OH)2 | dihidróxido de mercurio | hidróxido de mercurio(II) |
| Hg(OH) | hidróxido de mercurio | hidróxido de mercurio(I) |
El ion oxhidrilo
Las moléculas de agua se encuentran en movimiento continuo. En ocasiones los choques entre las moléculas tienen la suficiente energía para que un ion hidrógeno () se desprenda de una molécula de agua. Una molécula que pierde un ión hidrógeno se encuentra cargada negativamente en forma de un ion hidroxilo ()

- Formación del ion hidróxido o hidroxilo
- La molécula de agua es neutra y tiene un total de 10 protones (8 del oxigeno más 2 de los dos átomos de hidrógeno) y 10 electrones ( 8 del oxígeno y 2 de los átomos de hidrógeno).
- Al desprenderse un ion hidrógeno se queda con 9 protones (8 +1) y con los mismos 10 electrones.
- Así queda la molécula cargada negativamente , que es el ión hidróxido o hidroxilo
-
Estructura 3D del ion hidroxilo
-
Estructura de Lewis del ion hidroxilo
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Hidróxidosː Actividades
1º.- Completa
2º.- Completa
| Fórmula | UIPAC | Sistemática |
| Li (OH) | hidróxido de litio | |
| Be (OH)2 | dihidróxido de berilio | |
| dihidróxido de magnesio | ||
| hidróxido de escandio(III) | ||
| dihidróxido de magnesio | ||
| V(OH)2 | ||
| V(OH)4 | ||
| V(OH)5 | hidróxido de vanadio(V) | |
| dihidróxido de vanadio | ||
| Co(OH)3 | ||
| tetrahidróxido de cerio | ||
| hidróxido de mercurio(II) |
3º.- Completa
4º.- Completa
5º.- Completa
| Compuesto | Nomenclatura sistemática | Nomenclatura Stock |
|---|---|---|
| hidróxido de sodio | ||
| hidróxido de litio | ||
| hidróxido de plomo (II) | ||
| trihidróxido de aluminio | ||
| monohidróxido de aluminio | ||
| hidróxido de cobre(II) | ||
| hidróxido de plomo (IV) | ||
| hidróxido de potasio | ||
| hidróxido de zinc | ||
| hidróxido de mercurio(II) | ||
| hidróxido de mercurio(I) |
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Oxácidos
Los oxácidos son compuestos que contienen hidrógeno, oxígeno y al menos otro elemento no metal.
Esto quiere decir que son compuestos ternarios (formados por tres tipos de átomos), y que siempre mantienen el mismo orden (hidrógeno, un no metal y oxígeno).
También podemos decir que se forman por reacción de un óxido no metálico y agua.
- Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición.
Ejemplos de oxácidos[1][2][3][4]
- Ácido sulfúrico (H2SO4). Formado por la reacción de síntesis de una molécula de H2O con una molécula de trióxido de azufre SO3
- Ácido sulfuroso (H2SO3). Formado por la reacción de síntesis de una molécula de H2O con una molécula de dióxido de azufre SO2
¿Cómo se nombran los oxácidos?
Los oxácidos se nombran siguiendo la nomenclatura tradicional en -oso e -ico. Cuando un elemento presenta dos posibilidades de combinación se utiliza la terminación -oso para el compuesto en el que actúa con menor número de oxidación y la terminación -ico para el mayor número de oxidación.
Si el elemento presenta cuatro números de oxidación se emplea el prefijo -hipo y la terminación -oso para el menor, después la terminación -oso, a continuación la terminación -ico, y para el número de oxidación mayor el prefijo -per y la terminación -ico
Escritura de un oxácido
- Primero se escribe el hidrógeno.
- A continuación el no metal
- Por último el oxígeno.
Con el número de oxidación del no metal siendo par
- Si el número de oxidación del no metal es par, al hidrógeno le corresponde el subíndice 2.
- Se suma el número de oxidación del no metal con el 2 del hidrógeno y se divide entre el número de oxidación del oxígeno, que es -2, y el resultado es el subíndice del oxígeno.
Ejemplo: formular los ácidos que se pueden formar con el azufre cuando actúa con números de oxidación: +4 y +6.
- Con número de oxidación +4
- H2 S O3
- (4+2): 2 = 3; queda H2SO3 (ácido sulfuroso)
- Con número de oxidación +6
- H2 S O4
- (6+2): 2 = 4; queda H2SO4 (ácido sulfúrico)
Con el número de oxidación del no metal siendo impar
- Si el número de oxidación del no metal es impar, al hidrógeno le corresponde el subíndice 1.( cuando el no metal es el fósforo, el subíndice es 3)
- Se suma el número de oxidación del no metal con el 1 del hidrógeno y se divide entre el número de oxidación del oxígeno, que es -2, y el resultado es el subíndice del oxígeno.
Ejemplo: formular los ácidos que se pueden formar con el nitrógeno cuando actúa con números de oxidación: +3 y +5.
- Con número de oxidación +3
- H1 N O2
- (3+1): 2 = 2; queda HNO2 (Ácido nitroso)
- Con número de oxidación +5
- H1 N O3
- (5+1): 2 = 3; queda HNO3 (Ácido nítrico)
Otra forma de escribir los oxácidos
También podemos decir que los oxácidos se forman por reacción de un óxido no metálico y agua.
- + → y simplificando → (Ácido hipocloroso) ya que el cloro
actúa con el número de oxidación menor que es +1 - + → y simplificando → (Ácido cloroso) ya que el cloro actúa con el número de oxidación +3
- + → y simplificando → (Ácido clórico) ya que el cloro actúa con el número de oxidación +5
- + → y simplificando → (Ácido perclórico) ya que el cloro actúa con el número de oxidación +7
| ÁCIDOS | |||
|---|---|---|---|
| HIO | Ácido hipoyodoso | H3PO2 | Ácido hipofosforoso |
| HIO2 | Ácido yodoso | H3PO3 | Ácido fosforoso |
| HIO3 | Ácido yódico | H3PO4 | Ácido fosfórico |
| HIO4 | Ácido peryódico | HClO2 | Ácido cloroso |
| H2SO2 | Ácido hiposulfuroso | HClO4 | Ácido perclórico |
| H2SO3 | Ácido sulfuroso | H2TeO4 | Ácido telúrico |
| H2SO4 | Ácido sulfúrico | H3AsO3 | Ácido arsenioso |
| H2SeO3 | Ácido selenioso | H2CO3 | Ácido carbónico |
| H3SbO2 | Ácido hipoantimonioso | H3BO3 | Ácido bórico |
| H3SbO4 | Ácido antimonioso | HNO3 | Ácido nítrico |
Oxácidos
| Fórmula | Nombre | Formulación | Oxido + agua |
no metal |
hidrógeno |
oxígeno |
| H2SO2 | ácido hiposulfuroso | H = le corresponde el 2 por ser par el nº del azufre; O = 2 por la operación:(2+2): 2=2 |
SO+H2O =
H2SO2 |
+2 | +1 | -2 |
| H2SO3 | ácido sulfuroso | H = le corresponde el 2 por ser par el nº del azufre; O = 3 por la operación:(4+2): 2=3 |
SO2+H2O =
H2SO3 |
+4 | +1 | -2 |
| H2SO4 | ácido sulfúrico | H = le corresponde el 2 por ser par el nº del azufre; O = 4 por la operación:(6+2): 2=4 |
SO3+H2O =
H2SO4 |
+6 | +1 | -2 |
| HNO | ácido hiponitroso | H = le corresponde el 1 por ser impar el nº del nitrógeno; O = 1 por la operación:(1+1): 2=1 |
N2O+H2O =
H2N2O2 = HNO |
+1 | +1 | -2 |
| HNO2 | ácido nitroso | H = le corresponde el 1 por ser impar el nº del nitrógeno; O =2 por la operación:(3+1): 2=2 |
N2O3+H2O =
H2N2O4 = HNO2 |
+3 | +1 | -2 |
| HNO3 | ácido nítrico | H = le corresponde el 1 por ser impar el nº del nitrógeno; O = 3 por la operación:(5+1): 2=3 |
N2O5+H2O =
HN2O6 = HNO3 |
+5 | +1 | -2 |
| HClO | ácido hipocloroso | H = le corresponde el 1 por ser impar el nº del cloro; O = 1 por la operación:(1+1): 2=1 |
Cl2O+H2O =
H2Cl2O2 = HClO |
+1 | +1 | -2 |
| HClO2 | ácido cloroso | H = le corresponde el 1 por ser impar el nº del cloro; O = 2 por la operación:(3+1): 2=2 |
Cl2O3+H2O =
H2Cl2O4 = HClO2 |
+3 | +1 | -2 |
| HClO3 | ácido clórico | H = le corresponde el 1 por ser impar el nº del cloro; O =3 por la operación:(5+1): 2=3 |
Cl2O5+H2O =
H2Cl2O6 = HClO3 |
+5 | +1 | -2 |
| HClO4 | ácido perclórico | H = le corresponde el 1 por ser impar el nº del cloro; O = 4 por la operación:(7+1): 2=4 |
Cl2O7+H2O =
H2Cl2O8 = HClO4 |
+7 | +1 | -2 |
| HIO | ácido hipoyodoso | H = le corresponde el 1 por ser impar el nº del yodo; O = 1 por la operación:(1+1): 2=1 |
I2O+H2O =
H2I2O2 = HIO |
+1 | +1 | -2 |
| HIO2 | ácido yodoso | H = le corresponde el 1 por ser impar el nº del yodo; O = 2 por la operación:(3+1): 2=2 |
I2O3+H2O =
H2I2O4 = HIO2 |
+3 | +1 | -2 |
| HIO3 | ácido yódico | H = le corresponde el 1 por ser impar el nº del yodo; O =3 por la operación:(5+1): 2=3 |
I2O5+H2O =
H2I2O6 = HIO3 |
+5 | +1 | -2 |
| HIO4 | ácido peryódico | H = le corresponde el 1 por ser impar el nº del yodo; O = 4 por la operación:(7+1): 2=4 |
I2O7+H2O =
H2I2O8 = HIO4 |
+7 | +1 | -2 |
| H2SeO3 | ácido selenioso | H = le corresponde el 2 por ser par el nº del selenio; O = 3 por la operación:(4+2): 2=3 |
SeO2+H2O =
H2SeO3 = |
+4 | +1 | -2 |
| H2SeO4 | ácido selénico | H = le corresponde el 2 por ser par el nº del selenio; O = 4 por la operación:(6+2): 2=4 |
SeO3+H2O =
H2SeO4 = |
+6 | +1 | -2 |
| H2TeO3 | ácido teluroso | H = le corresponde el 2 por ser par el nº del telurio; O =3 por la operación:(4+2): 2=3 |
TeO2+H2O =
H2TeO3 = |
+4 | +1 | -2 |
| H2TeO4 | ácido telúrico | H = le corresponde el 2 por ser par el nº del telurio; O = 4 por la operación:(6+2): 2=4 |
TeO3+H2O =
H2TeO4 = |
+6 | +1 | -2 |
| HBrO | ácido hipobromoso | H = le corresponde el 1 por ser impar el nº del bromo; O = 1 por la operación:(1+1): 2=1 |
Br2O+H2O =
H2Br2O2 = HBrO |
+1 | +1 | -2 |
| HBrO2 | ácido bromoso | H = le corresponde el 1 por ser impar el nº del bromo; O = 2 por la operación:(3+1): 2=2 |
Br2O3+H2O =
H2Br2O4 = HBrO2 |
+3 | +1 | -2 |
| HBrO3 | ácido brómico | H = le corresponde el 1 por ser impar el nº del bromo; O = 3 por la operación:(5+1): 2=3 |
Br2O5+H2O
H2Br2O6 HBrO3 |
+5 | +1 | -2 |
| HBrO4 | ácido perbrómico | H = le corresponde el 1 por ser impar el nº del bromo; O = 4 por la operación:(7+1): 2=4 |
Br2O7+H2O =
H2Br2O8 = HBrO4 |
+7 | +1 | -2 |
| H2CO3 | ácido carbónico | H = le corresponde el 2 por ser par el nº del carbono; O = 3 por la operación:(4+2): 2=3 |
CO2+H2O =
H2CO3 = |
+4 | +1 | -2 |
| H3PO3 | ácido fosforoso | H = le corresponde el 3 por ser el fósforo; O = 3 por la operación:(3+3): 2=3 |
P2O3+3H2O =
H6P2O6 = H3PO3 = |
+3 | +1 | -2 |
| H3PO4 | ácido fosfórico | H = le corresponde el 3 por ser el fósforo; O = 4 por la operación:(5+3): 2=4 |
P2O5+3H2O =
H6P2O8 = H3PO4 |
+5 | +1 | -2 |

Referencias
- ↑ Dianelys Ondarse Álvarez (7 junio, 2022). «Oxácidos (u oxiácidos)». Consultado el 27 de noviembre de 2022.
- ↑ «Ejemplos de Ácidos Oxácidos» (5 de octubre de 2015). Consultado el 27 de noviembre de 2022.
- ↑ Gabriel Bolívar (9 de enero de 2019). «Oxácido: qué son, características, cómo se forman, ejemplos». Consultado el 27 de noviembre de 2022.
- ↑ Anne Marie Helmenstine (22 de octubre de 2019). «Common Oxoacid Compounds». Consultado el 27 de noviembre de 2022.
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Oxácidos: Actividades
1º.- Completa
2º.- Completa
3º.- Completa la tabla de oxácidos
| Fórmula | Nombre | Formulación | no metal |
nº ox. hidrógeno |
nº ox. oxígeno |
| H2SO2 | H = le corresponde el 2 por ser par el nº del azufre; O = 2 por la operación:(2+2): 2=2 |
+1 | -2 | ||
| ácido sulfuroso | H = le corresponde el 2 por ser par el nº del azufre; O = 3 por la operación:(4+2): 2=3 |
+4 | +1 | -2 | |
| ácido sulfúrico | +6 | +1 | -2 | ||
| HNO | H = le corresponde el 1 por ser impar el nº del nitrógeno; O = 1 por la operación:(1+1): 2=1 |
+1 | -2 | ||
| HNO2 | H = le corresponde el 1 por ser impar el nº del nitrógeno; O =2 por la operación:(3+1): 2=2 |
+3 | +1 | -2 | |
| ácido nítrico | +1 | -2 | |||
| HClO | H = le corresponde el 1 por ser impar el nº del cloro; O = 1 por la operación:(1+1): 2=1 |
+1 | +1 | -2 | |
| HClO2 | ácido cloroso | H = le corresponde el 1 por ser impar el nº del cloro; O = 2 por la operación:(3+1): 2=2 |
+3 | +1 | -2 |
| HClO3 | H = le corresponde el 1 por ser impar el nº del cloro; O =3 por la operación:(5+1): 2=3 |
+1 | -2 | ||
| HClO4 | ácido perclórico | +7 | +1 | -2 | |
| ácido hipoyodoso | H = le corresponde el 1 por ser impar el nº del yodo; O = 1 por la operación:(1+1): 2=1 |
+1 | -2 | ||
| HIO2 | +3 | +1 | -2 | ||
| HIO3 | ácido yódico | H = le corresponde el 1 por ser impar el nº del yodo; O =3 por la operación:(5+1): 2=3 |
+5 | +1 | -2 |
| HIO4 | H = le corresponde el 1 por ser impar el nº del yodo; O = 4 por la operación:(7+1): 2=4 |
+1 | -2 | ||
| H2SeO3 | H = le corresponde el 2 por ser par el nº del selenio; O = 3 por la operación:(4+2): 2=3 |
+4 | +1 | -2 | |
| ácido selénico | +1 | -2 | |||
| H2TeO3 | H = le corresponde el 2 por ser par el nº del telurio; O =3 por la operación:(4+2): 2=3 |
+4 | +1 | -2 | |
| ácido telúrico | H = le corresponde el 2 por ser par el nº del telurio; O = 4 por la operación:(6+2): 2=4 |
+1 | -2 | ||
| HBrO | ácido hipobromoso | H = le corresponde el 1 por ser impar el nº del bromo; O = 1 por la operación:(1+1): 2=1 |
+1 | +1 | -2 |
| HBrO2 | ácido bromoso | +3 | +1 | -2 | |
| HBrO3 | H = le corresponde el 1 por ser impar el nº del bromo; O = 3 por la operación:(5+1): 2=3 |
+1 | -2 | ||
| HBrO4 | +1 | -2 | |||
| ácido carbónico | H = le corresponde el 2 por ser par el nº del carbono; O = 3 por la operación:(4+2): 2=3 |
+4 | +1 | -2 | |
| H3PO3 | +3 | +1 | -2 | ||
| ácido fosfórico | H = le corresponde el 3 por ser el fósforo; O = 4 por la operación:(5+3): 2=4 |
+5 | +1 | -2 |
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Sales binarias
Las sales binarias son combinaciones de 2 elementos distintos del hidrógeno y del oxígeno. La unión de un elemento metálico con un elemento no metálico forman una sal neutra, mientras que la unión de un elemento no metálico con otro elemento no metálico forman una sal volátil.
Tipos
Los tipos de sales neutras que existen son: fluoruros, cloruros, bromuros, yoduros, astaturos, sulfuros, telururos, seleniuros, nitruros, fosfuros, arseniuros, antimoniuros, boruros, carburos y siliciuros.
Formulación
Su fórmula general es: MnNm donde M es el elemento metálico, n es el número de oxidación del no metal, N es el elemento no metálico y m es el número de oxidación del metal.[1]
Hay que tener en cuenta que el elemento no metálico siempre actúa con la valencia fija, y esta valencia será con la que actúa frente al hidrógeno. Por lo tanto los elementos no metálicos tendrán las siguientes valencias:
F-1, Cl-1, Br-1, I-1, At-1, S-2, Te-2, Se-2, N-3, P-3, As-3, Sb-3, B-3, C-4, Si-4 [2]¿Cómo se nombran las sales binarias?
Para nombrarlas en el sistema tradicional, Stock y sistemático se aplican las reglas generales usando el nombre del no metal con el sufijo –uro como nombre genérico seguido de la palabra de y el nombre del metal como nombre específico.
- Ejemplo 1º
- ; (sulfuro férrico), sulfuro de hierro(III) o trisulfuro de dihierro). El hierro actúa con el número de oxidación más alto (3) por eso lleva el sufijo -ico-
También se puede escribir la reacción incluyendo los números de oxidación en cada reactivo.
- Ejemplo 2º
- ; (bromuro de aluminio, bromuro de aluminio (III) o tribromuro de aluminio) (Se intercambian los números de oxidación: el 3 del aluminio al bromo y el 1 del bromo al aluminio)
o
- Ejemplo 3º
- ; (cloruro de sodio)
o
- ; (cloruro de sodio)

Sales binarias
| Fórmula | N. sistemática | N. Stok | Fórmula | N. sistemática | N. Stok |
| NaF | monofluoruro sódico | fluoruro sódico | MgCl2 | dicloruro de magnesio | cloruro de magnesio |
| KF | monofluoruro potásico | fluoruro potásico | ScCl3 | tricloruro de escandio | cloruro de escandio(III) |
| CrF2 | difluoruro de cromo | fluoruro de cromo(II) | TiCl4 | tetracloruro de titanio | cloruro de titanio(IV) |
| AlF3 | trifluoruro de aluminio | fluoruro de aluminio(III) | MnCl7 | heptacloruro de manganeso | cloruro de manganeso (VII) |
| CF4 | tetrafluoruro de carbono | fluoruro de carbono(IV) | FeCl3 | tricloruro de hierro | cloruro de hierro (III) |
| CBr2 | dibromuro de carbono | bromuro de carbono (II) | CI4 | tetrayoduro de carbono | yoduro de carbono (IV) |
| SbBr5 | pentabromuro de antimonio | bromuro de antimonio (V) | PmI3 | triyoduro de promecio | yoduro de promecio |
| AcAt3 | triastaturo de actinio | astaturo de actinio | FeS | monosulfuro de hierro | sulfuro de hierro (II) |
| TcAt7 | heptaastaturo de tecnecio | astaturo de tecnecio | Fe2S3 | trisulfuro de dihierro | sulfuro de hierro (III) |
| Bi2Te5 | pentatelururo de dibismuto | teleluro de bismuto (V) | CrSe3 | triseleniuro de cromo | seleniuro de cromo (VI) |
| NiTe | monotelururo de níquel | teleluro de níquel (II) | ZnSe | monoseleniuro de cinc | seleniuro de cinc |
| Li3N | mononitruro de trilitio | nitruro de litio | TaP | monofosfuro de tántalo | fosfuro de tántalo (III) |
| P3N5 | pentanitruro de trifósforo | nitruro de fósforo (V) | Ca3P2 | difosfuro de tricalcio | fosfuro de calcio |
| BAs | monoarseniuro de boro | arseniuro de boro | Sr3Sb2 | diantimoniuro de triestroncio | antimoniuro de estroncio |
| K3As | monoarseniuro de tripotasio | arseniuro de potasio | FeSb | monoantimoniuro de hierro | antimoniuro de hierro (III) |
| AlB | monoboruro de aluminio | boruro de aluminio | V2C | monocarburo de divanadio | carburo de vanadio(II) |
| Cu3B2 | diboruro de tricobre | boruro de cobre(II) | Mn2C | monocarburo de dimanganeso | carburo de manganeso (II) |
| Y4Si3 | trisiliciuro de tetraitrio | siliciuro de itrio | |||
| PbSi | monosiliciuro de plomo | sliciuro de plomo(IV) | |||
Referencias
Ejercicios
-------------------------------------------------------------------------------------------------------------------
ompuestos químicos: Sales binarias: Actividades
1º.- Completa
2º.- Completa
3º.- Completa
4º.- Completa la tabla de sales binarias
| Fórmula | N. sistemática | N. Stok | Fórmula | N. sistemática | N. Stok |
| NaF | monofluoruro sódico | fluoruro sódico | dicloruro de magnesio | ||
| fluoruro potásico | ScCl3 | ||||
| difluoruro de cromo | cloruro de titanio(IV) | ||||
| AlF3 | heptacloruro de manganeso | ||||
| tetrafluoruro de carbono | cloruro de hierro (III) | ||||
| dibromuro de carbono | yoduro de carbono (IV) | ||||
| SbBr5 | bromuro de antimonio (V) | PmI3 | triyoduro de promecio | ||
| astaturo de actinio | sulfuro de hierro (II) | ||||
| TcAt7 | Fe2S3 | trisulfuro de dihierro | |||
| Bi2Te5 | CrSe3 | triseleniuro de cromo | |||
| teleluro de níquel (II) | ZnSe | ||||
| mononitruro de trilitio | TaP | ||||
| nitruro de fósforo (V) | difosfuro de tricalcio | ||||
| arseniuro de boro | Sr3Sb2 | ||||
| K3As | antimoniuro de hierro (III) | ||||
| monoboruro de aluminio | V2C | ||||
| boruro de cobre(II) | carburo de manganeso (II) | ||||
| siliciuro de itrio | |||||
| monosiliciuro de plomo | |||||
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Oxisales
Catión


Un catión es un ion con carga eléctrica positiva, es decir, que ha perdido electrones.[1] Los cationes se describen con un estado de oxidación positivo. En términos químicos, es cuando un átomo neutro pierde uno o más electrones de su dotación original, este fenómeno se conoce como ionización.
La carga eléctrica de un protón es igual a la carga de un electrón. Entonces, la carga eléctrica total de un ion es la cantidad de protones en el ion menos la cantidad de electrones.
- Ejemplo: el catión K+ es un átomo de potasio (K) que ha perdido un electrón para quedar isoelectrónico (quedar con su última capa electrónica como) con el argón (el gas noble que le precede en la tabla periódica). El Mg2+ es un átomo de magnesio (Mg) que ha perdido 2 electrones para quedar isoelectrónico con el neón.
| Nombre IUPAC | Símbolo |
|---|---|
| Cationes simples | |
| Catión aluminio | Al3+ |
| Catión bario | Ba2+ |
| Catión berilio | Be2+ |
| Catión cesio | Cs+ |
| Catión calcio | Ca2+ |
Anión


Los aniones son átomos o radicales (grupos de átomos) que han ganado electrones. Como tienen más electrones que protones, los aniones tienen carga negativa.
Para nombrar los aniones monoatómicos se utiliza el nombre del elemento, cambiando la terminación por -uro, precedido por la palabra ion o anión.
- Por ejemplo: ion cloruro Cl-, ion bromuro Br-, ion yoduro I-. Excepto el O2- , denominado ión óxido
Estos son aniones monovalentes, lo que significa que tienen número de oxidación (capacidad de combinación) con un solo ion de hidrógeno. Asimismo existen aniones bivalentes, etc.
Oxisales
Las oxisales o sales ternarias, son compuestos formados por un metal, un no metal y oxígeno. Son consideradas como las sales de los ácidos oxoácidos, ya que éstas se forman por la sustitución de los hidrógenos del oxoácido por un metal.
Formulación
La fórmula general de las oxisales es Ma(XbOc)n donde M es el elemento metálico, X es el elemento no metálico y O es el oxígeno. Los valores de a, b y c corresponden a los valores del oxoácido del que procede y n es el número de oxidación del elemento metálico.
Nomenclatura
Los nombres de las sales derivan del ácido correspondiente manteniendo los prefijos, si los hay, y se cambia la terminación -oso del ácido por -ito (de la sal), y la terminación -ico por -ato (de la sal).
- Ejemplos
1.- Nitrato de bario
Esta sal deriva del ácido nítrico HNO3
- Se sustituye H por Ba y se le pone el subíndice del hidrógeno al bario
- Al grupo restante (NO3) se le pone como subíndice el número de oxidación del metal
- Queda Ba(NO3)2
2.- Sulfato de níquel(II)
Esta sal deriva del ácido sulfúrico H2SO4
- Se sustituye H por Ni y se le pone el subíndice del hidrógeno al níquel
- Al grupo restante (SO)4 se le pone como subíndice el número de oxidación del metal
- Queda Ni2(SO4)2 que simplificando queda NiSO4
Sales oxácidas
| H2SO2 | Li2SO2 | hiposulfito de litio | HNO | Ca(NO)2 | hiponitrito de calcio |
| H2SO3 | Li2SO3 | sulfito de litio | HNO2 | Ca(NO2)2 | nitrito de calcio |
| H2SO4 | Li2SO4 | sulfato de litio | HNO3 | Ca(NO3)2 | nitrato de calcio |
| H2CO3 | Sc2(CO3)3 | carbonato de escandio | H3BO3 | Ni3(BO3)2 | borato de níquel(II) |
| H2CO3 | Ti2(CO3 )2 =
TiCO3 |
carbonato de titanio(II) | H3BO3 | Ni3(BO3)3 =
NiBO3 |
borato de níquel(III) |
| H2CO3 | Ti2(CO3)3 | carbonato de titanio(III) | H3BO3 | Fe3(BO3)2 | borato de hierro(II) |
| H2CO3 | Ti2(CO3)4 =
Ti(CO3)2 |
carbonato de titanio(IV) | H3BO3 | Fe3(BO3)3 =
FeBO3 |
borato de hierro(III) |
| H2CO3 | V2(CO3)5 | carbonato de vanadio(V) | H3BO3 | Hg3BO3 | borato de mercurio(I) |
| H3BO3 | Hg3(BO3)2 | borato de mercurio(II) | |||
| HClO | NaClO | hipoclorito de sodio | HClO | Mn(ClO)2 | hipoclorito de manganeso(II) |
| HClO2 | NaClO2 | clorito sódico | HClO | Mn(ClO)3 | hipoclorito de manganeso(III) |
| HClO3 | NaClO3 | clorato sódico | HClO2 | Mn(ClO2)2 | clorito de manganeso(II) |
| HClO4 | NaClO4 | perclorato sódico | HClO2 | Mn(ClO2)3 | clorito de manganeso(III) |
| HClO | Ca(ClO)2 | hipoclorito de calcio | HClO3 | Mn(ClO3)2 | clorato de manganeso(II) |
| HClO2 | Ca(ClO2)2 | clorito de calcio | HClO3 | Mn(ClO3)3 | clorato de manganeso(III) |
| HClO3 | Ca(ClO3)2 | clorato de calcio | HClO4 | Mn(ClO4)2 | perclorato de manganeso(II) |
| HClO4 | Ca(ClO4)2 | perclorato de calcio | HClO4 | Mn(ClO4)3 | perclorato de manganeso(III) |
Sales ácidas
Las sales ácidas se forman cuando no todos los átomos de hidrógeno de un ácido son sustituidos por metales y solamente son sustituidos parcialmente, quedando hidrógenos por sustituir en la sal.
Nomenclatura
Se nombran indicando en primer lugar la cantidad de hidrógeno no sustituido y luego el nombre de la sal
- Ejemplos
1.- NaHSO4 hidrógenosulfato de sodio
Esta sal deriva del ácido sulfúrico H2SO4
- Se sustituye un H por un Na ya que este tiene número de oxidación 1
- Al grupo restante (HSO4) se le pone como subíndice el número de oxidación del sodio
- Queda NaHSO4
2.- Fe(HSO4 )2 hidrógenosulfato de hierro(II)
Esta sal deriva del ácido sulfúrico H2SO4
- Se sustituye un H por un Fe
- Al grupo restante (HSO4) se le pone como subíndice el número de oxidación del sodio que es 2
- Queda Fe(HSO4 )2
Sales ácidas
| H2SO3 | LiHSO3 | hidrógenosulfito de litio | H2CO | Cr(HCO3)3 | hidrógenocarbonato de cromo(III) |
| H2SO4 | LiHSO4 | hidrógenosulfato de litio | H2CO3 | NaHCO3 | hidrógenocarbonato de sodio |
| H3PO4 | KH2PO4 | dihidrógenofosfato de potasio | H3 BO33 | Cr(H2BO3)3 | dihidrógenoborato de cromo(III) |
| H3PO4 | Al(H2PO4)3 | dihidrogenofosfato de aluminio | H3 BO33 | Cr(H2BO3)2 | dihidrógenoborato de cromo(II) |
| H2S | Fe(HS)2 | hidrogenosulfuro de hierro(II) | H2S | Fe(HS)3 | hidrogenosulfuro de hierro(III) |
-----------------------------------------------------------------------------------------------------------------------------------------------------
Ejercicios
Referencias
- ↑ Tornell, Andrés Pérez (1988) (en es). [[1] Química general. Apuntes de formulación química]. EDITUM. ISBN 9788476841211. [2]. Consultado el 25 de julio de 2019.
-------------------------------------------------------------------------------------------------------------------
Compuestos químicos: Oxisales: Actividades
1º.- Completa
2º.- Completa
3º.- Completa
4º.- Completa
5º.- Completa la tabla de las sales oxácidas
| H2SO2 | Li2SO2 | HNO | Ca(NO)2 | ||
| H2SO3 | sulfito de litio | HNO2 | Ca(NO2)2 | nitrito de calcio | |
| H2SO4 | Li2SO4 | HNO3 | Ca(NO3)2 | ||
| H2CO3 | carbonato de escandio | H3BO3 | borato de níquel(II) | ||
| H2CO3 | Ti2(CO3 )2 =
TiCO3 |
H3BO3 | Ni3(BO3)3 =
NiBO3 |
||
| H2CO3 | carbonato de titanio(III) | H3BO3 | Fe3(BO3)2 | ||
| H2CO3 | Ti2(CO3)4 =
Ti(CO3)2 |
H3BO3 | borato de hierro(III) | ||
| H2CO3 | carbonato de vanadio(V) | H3BO3 | Hg3BO3 | ||
| H3BO3 | borato de mercurio(II) | ||||
| HClO | hipoclorito de sodio | HClO | hipoclorito de manganeso(II) | ||
| HClO2 | NaClO2 | HClO | hipoclorito de manganeso(III) | ||
| HClO3 | NaClO3 | HClO2 | clorito de manganeso(II) | ||
| HClO4 | NaClO4 | HClO2 | Mn(ClO2)3 | ||
| HClO | Ca(ClO)2 | HClO3 | Mn(ClO3)2 | ||
| HClO2 | clorito de calcio | HClO3 | clorato de manganeso(III) | ||
| HClO3 | clorato de calcio | HClO4 | Mn(ClO4)2 | ||
| HClO4 | perclorato de calcio | HClO4 | perclorato de manganeso(III) | ||
6º.- Completa la tabla de las sales ácidas
| H2SO3 | hidrógenosulfito de litio | H2CO | Cr(HCO3)3 | ||
| H2SO4 | LiHSO4 | H2CO3 | hidrógenocarbonato de sodio | ||
| H3PO4 | dihidrógenofosfato de potasio | H3 BO33 | Cr(H2BO3)3 | ||
| H3PO4 | Al(H2PO4)3 | H3 BO33 | dihidrógenoborato de cromo(II) | ||
| H2S | Fe(HS)2 | H2S | hidrogenosulfuro de hierro(III) | ||