Curso de alemán nivel medio con audio/Lección 077b
Apariencia
- índice
- Lección 076b ← Lección 077b → Lección 078b
- Lección 076 ← Lección 077 → Lección 078
Química inorgánica
[editar]M-ES-DE-077-1
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---

- Química inorgánica
- ---
- La química inorgánica se encarga del estudio integrado de la formación, composición, estructura y reacciones de los elementos y compuestos inorgánicos (por ejemplo, ácido sulfúrico o carbonato cálcico); es decir, los que no poseen enlaces carbono-hidrógeno, porque éstos pertenecen al campo de la química orgánica. Dicha separación no es siempre clara, como por ejemplo en la química organometálica que es una superposición de ambas.
- Antiguamente se definía como la química de la materia inorgánica, pero quedó obsoleta al desecharse la hipótesis de la fuerza vital, característica que se suponía propia de la materia viva que no podía ser creada y permitía la creación de las moléculas orgánicas. Se suelen clasificar los compuestos inorgánicos según su función en ácidos, bases, óxidos y sales, y los óxidos se les suele dividir en óxidos metálicos (óxidos básicos o anhídridos básicos) y óxidos no metálicos (óxidos ácidos o anhídridos ácidos).
- El término función se les da porque los miembros de cada grupo actúan de manera semejante.
- El término anhídrido básico se refiere a que cuando un óxido metálico reacciona con agua generalmente forma una base, mientras que los anhídridos ácidos generalmente reaccionan con agua formando un ácido.
- Al ver una fórmula, generalmente lo podemos ubicar en uno de estos grupos.
- ---
- Ácidos: cuando observamos el símbolo del hidrógeno al extremo izquierdo de la fórmula, como HCl (ácido clorhídrico)
- Bases: cuando observamos un metal al principio de la fórmula unido al anión hidróxido (OH-) al final, como NaOH (hidróxido de sodio).
- Óxidos: a los compuestos binarios del oxígeno, (ojo, debe ser binario, contener sólo dos elementos en la fórmula, uno de ellos es el oxígeno que va escrito su símbolo al extremo derecho. Óxido metálico cuando es un metal el que se enlaza al oxígeno (óxidos metálicos binarios), como Fe2O3 (óxido férrico). Óxido no metálico cuando es un no-metal el enlazado al oxígeno, como CO (monóxido de carbono).
- Sales: son aquellos que están formadas por un metal y un anión que no es ni óxido ni hidróxido, como el NaCl (cloruro sódico)
- Como excepción tenemos que el ion amonio (NH4+) puede hacer la función de un metal en las sales, y también se encuentra en las disoluciones de amoniaco en agua, ya que no existe el compuesto hidróxido amónico, NH4OH, ni ha sido detectado en ningún sistema mediante condiciones especiales.
- ---
- Campo de trabajo
- El nombre tiene su origen en la época en la que todos los compuestos del carbono se obtenían de seres vivos; de ahí la química del carbono se denomina química orgánica. La química de compuestos sin carbono, fue, por ende, llamada química inorgánica.
- Actualmente, se obtienen compuestos orgánicos en el laboratorio, de forma que la separación es artificial. Algunas de las sustancias con carbono que entran en el campo de la química inorgánica incluyen:
- grafito, diamante (fulereno y nanotubos se consideran más bien orgánicos)
- carbonatos y bicarbonatos
- carburo
- ---
- Áreas de interés
- Apartados de interés de la química inorgánica incluyen:
- La tabla periódica de los elementos:
- Química de los elementos representativos
- Química de los metales de transición
- Química de las tierras raras
- Química de coordinación
- Química de los compuestos con enlace metal-metal
- La tabla periódica de los elementos:
- ---
- Áreas relacionadas
- Áreas de solapamiento con otros campos del conocimiento incluyen: (todas las paginas siguientes han sido creadas por Alumnos Arcángel)
- Ciencia de materiales
- Geoquímica
- Magnetoquímica
- Mineralogía
- Química analítica
- Química bioinorgánica
- Química del estado sólido
- Química física
- Química medioambiental
- Química organometálica
- ---
- Compuestos y sustancias importantes
- Hay muchísimos compuestos y sustancias inorgánicas de gran importancia, comercial y biológica. Entre ellos:
- muchos fertilizantes, como el nitrato amónico, potásico, fosfatos o sulfatos...
- muchas sustancias y disolventes cotidianos, como el amoníaco, el agua oxigenada, la lejía, el salfumán
- muchos gases de la atmósfera, como el oxígeno, el nitrógeno, el dióxido de carbono, los óxidos de nitrógeno y de azufre...
- todos los metales y las aleaciones
- los vidrios de ventanas, botellas, televisores...
- las cerámicas de utensilios domésticos, industriales, o las losetas de las lanzaderas espaciales.
- el carbonato de calcio de nuestros huesos
- los chips de silicio semiconductores que hacen posible la microelectrónica y los ordenadores
- las pantallas LCD
- el cable de fibra óptica
- muchos catalizadores de interés industrial
- el centro activo de las metaloenzimas
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: inorgánica Vikidia:Química inorgánica
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Química orgánica
[editar]M-ES-DE-077-2
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---
- Química orgánica
- ---
- La química orgánica o química del carbono es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
- La gran cantidad de compuestos orgánicos que existen tiene su explicación en las características del átomo de carbono, que tiene cuatro electrones en su capa de valencia: según la regla del octeto necesita ocho para completarla, por lo que forma cuatro enlaces (valencia = 4) con otros átomos formando un tetraedro, una pirámide de base triangular.
- ---
- Reacción química
- ---
- Una reacción química es el proceso químico en el que una o más sustancias sufren transformaciones químicas para convertirse en otra u otras. A la representación simbólica (con letras y números) de las reacciones se les llama ecuaciones químicas.
- ---
- Metales de transición
- ---
- Los metales de transición o elementos de transición son aquellos elementos químicos que están situados en la parte central de la tabla periódica, en el bloque d. Casi todos son metales típicos, de elevada dureza, con puntos de fusión y ebullición altos, buenos conductores tanto del calor como de la electricidad.
- Los metales de transición son:
- Escandio (Sc)
- Titanio (Ti)
- Vanadio (V)
- Cromo (Cr)
- Manganeso (Mn)
- Hierro (Fe)
- Cobalto (Co)
- Níquel (Ni)
- Cobre (Cu)
- Zinc (Zn)
- Itrio (Y)
- Zirconio (Zr)
- Niobio (Nb)
- Molibdeno (Mo)
- Tecnecio (Tc)
- Rutenio (Ru)
- Rodio (Rh)
- Paladio (Pd)
- Plata (Ag)
- Cadmio (Cd)
- ect.
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: orgánica Vikidia:Química orgánica
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Sal (química)
[editar]M-ES-DE-077-3
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---
- Sal (química)
- ---
- Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa). Son el producto típico de una reacción química entre una base y un ácido. La base proporciona el catión y el ácido el anión.
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: (química) Vikidia:Sal (química)
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Sidra
[editar]M-ES-DE-077-4
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---
- Sidra
- ---
- La sidra es una bebida alcohólica procedente del zumo de las manzanas fermentado. Contiene CO2 natural que se muestra al moverla cuando se bebe y una graduación alcohólica de unos 5°.
- ---
- Elaboración
- Para elaborarla se lavan las manzanas y se aplastan por medios mecánicos en una máquina llamada prensa. El zumo que producen se lleva a unos contenedores.
- Allí unos microorganismos llamados levaduras que existen en el aire y que llegan al zumo, se multiplican, alimentándose del azúcar hasta que convierten todo el azúcar que contenía el jugo en alcohol. Esto es lo que se llama fermentación. Cuando han consumido todo el azúcar, las levaduras dejan de reproducirse y la fermentación se detiene. El zumo de las manzanas se ha convertido en sidra
- ---
- Escanciado
- La sidra natural se sirve escanciada en un vaso especial ancho y bajo: pasando la sidra de la botella al vaso desde una altura considerable para que aflore el gas CO2 (anhídrido carbónico) natural que contiene.
- ---
- Solidificación
- ---
- La solidificación es un proceso que consiste en el cambio de estado de la materia, de líquido a sólido, a través de la reducción de la temperatura o de su compresión. Es el proceso inverso a la fusión. La temperatura de solidificación depende de las características intrínsecas de la materia.
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: Vikidia:Sidra
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Sustancia
[editar]M-ES-DE-077-5
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---
- Sustancia
- ---
- La sustancia es la clase de materia de la que están formados los cuerpos.
- Clasificación
- Las sustancias que se pueden observar se clasifican en sustancias puras y mezclas.
- Se llama sustancia pura a aquella que no se puede descomponer en otras mediante procedimientos físicos (como calentamiento o un campo magnético). Es posible que la sustancia pura se descomponga mediante reacciones químicas; si se descompone en más de un elemento químico, se dice que la sustancia es compuesta; en caso contrario, se dice que es una sustancia simple.
- Se llama mezcla al resultado de la combinación de varias sustancias puras, y es posible la separación de éstas mediante procedimientos físicos (destilación, evaporación, suspensión y filtración) y mecánicos (decantación e imantación).
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: Vikidia:Sustancia
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Ácido
[editar]M-ES-DE-077-6
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---
Boquerones en vinagre. - Ácido
- ---
- Un ácido es una sustancia química que tiene sabor agrio y reacciona con algunos metales produciendo hidrógeno gaseoso. Algunos ejemplos son: el ácido acético (en el vinagre), el ácido clorhídrico (en los jugos gástricos), el ácido acetilsalicílico (en la aspirina), o el ácido sulfúrico (usado en baterías de automóvil).
- Muchas moléculas importantes de las que forman los seres vivos son ácidos. Los ácidos nucleicos como el ADN contienen el código genético que determina muchas de las características de un organismo (persona, animal o vegetal) y es transmitido de padres a hijos en lo que se conoce como herencia genética.
- ---
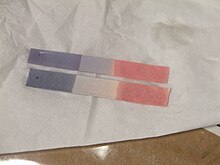
Papel de tornasol - Propiedades de los ácidos
- Tienen sabor agrio como en el caso del ácido cítrico en la naranja y el limón.
- Algunos son corrosivos y producen quemaduras de la piel.
- Reaccionan con algunos metales formando una sal e hidrógeno.
- Reaccionan con bases para formar una sal y agua.
- ---
- Medida de la acidez de una sustancia
- La acidez es la medida de los iones hidrógeno en disolución. Se suele indicar como pH. La escala de pH va de 0 a 14, siendo ácidas las sustancias con pH menores a 7. El pH = 7 indica la neutralidad de la sustancia. Así el agua pura tendría pH = 7. Si la sustancia tiene un ph más bajo se considera ácida y si es más alto básica.
- La acidez se puede medir con papel tornasol que lleva incorporado un colorante azul violeta el cual tiene la propiedad de cambiar hacia el rojo en las disoluciones ácidas y hacia el azul en las disoluciones básicas. Los diferentes tintes de degradación que adoptará el colorante permiten obtener el grado de acidez o alcalinidad de un producto.
- ---
- pH neutro
- En productos de aseo y limpieza se suele hacer uso del término "pH neutro". En este caso la neutralidad hace referencia a un nivel de pH 5,5. Debido a las características de la piel humana, cuyo pH es 5,5, se indica neutralidad de pH en este tipo de productos que están destinados a entrar en contacto con nuestra piel para destacar su no agresividad. Si se aplicaran productos de pH 7 a nuestra piel se produciría una variación del pH de ésta con posibles consecuencias negativas.
- ---
- Ácido cítrico
- El ácido cítrico (del latín "citrus", limón) es un ácido que abunda mucho en los limones y las naranjas.
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: Vikidia:Ácido
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Ciencia
[editar]M-ES-DE-077-7
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---
- Ciencia
- ---
- Una ciencia es un estudio ordenado que mediante observación, hipótesis y experimentos comprobables intenta explicar y comprender algo.
- Las ciencias se dividen en tres tipos, las ciencias formales, las ciencias sociales y las ciencias naturales:
- ciencias formales: Son las ciencias que estudian el razonamiento lógico, como la lógica o las matemáticas.
- ciencias sociales: Son las que se encargan de estudiar una sociedad socialmente, económicamente, políticamente, culturalmente, etc. en un tiempo y lugar determinado, como la antropología o la economía.
- ciencias naturales: Son las que estudian la naturaleza, como la química, la física o la biología.
- También, la epistemología (rama de la filosofía que estudia el conocimiento científico) clasifica las ciencias en dos grupos más generales:
- las ciencias fácticas o factuales (aquellas que estudian hechos o fenómenos reales y, por lo general, temporales; por ejemplo: geografía, biología, etc.)
- y las ciencias formales (las que estudian ideas creadas por la mente; por ejemplo: matemáticas)
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: Vikidia:Ciencia
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
Cuerpo
[editar]M-ES-DE-077-8
- Übersetzen Sie den Artikel schriftlich ins Deutsche! (Schreiben Sie Ihre Übersetzung auf die Diskussionsseite dieser Übung!)
- Übersetzen Sie den Artikel danach mündlich ins Deutsche! (ohne Ihre Aufzeichnungen)
- ---

Vela roja. Ejemplo de un cuerpo - Cuerpo
- ---
- Se llama cuerpo a una porción limitada de materia. El teclado con el que escribimos es un cuerpo; ocupa un lugar en el espacio y está perfectamente limitado y separado de los otros cuerpos que le rodean, por ejemplo el monitor, el ratón, el escáner. Una botella de plástico y el aire que contiene son dos cuerpos porque son dos porciones limitadas de materia.
- ---
- Propiedades de los cuerpos
- Tienen volumen: es el espacio que ocupa su materia. Debido a que la materia no se puede penetrar, un mismo espacio no puede estar ocupado por dos cuerpos distintos simultáneamente.
- Tienen masa: la masa de un cuerpo es la cantidad de materia que posee.
- Son tridimensionales, es decir, se extienden a lo ancho, a lo alto y a lo largo.
- Todo cambio o modificación en las propiedades de los cuerpos reciben el nombre de fenómeno. Si afecta solo a la forma de « estar » del cuerpo recibe el nombre de fenómeno físico. Por ejemplo: los cambios de estado de la materia, como la fusión del hielo, la ebullición del agua, la imantación del hierro, la refexión de la luz en un espejo. Su estudio corresponde a la Física. Si afecta a la manera de « ser » del cuerpo recibe el nombre de fenómeno químico. Ejemplo. Las reacciones en las que obtenemos diversas sustancias químicas; así la obtención del hidrógeno a partir del ácido sulfúrico reaccionando con trocitos de zinc. Su estudio corresponde a la Química.
fuente: Vikidia - Vikidia - La enciclopedia libre de contenido adaptado para niños y jóvenes que todos pueden editar)
- fuente/Quelle: Vikidia:Cuerpo
- licencia: CC-BY-SA (español)
- Lizenz: CC-BY-SA (deutsch)
- licence: CC BY-SA 3.0 (english)
- índice
- Lección 076b ← Lección 077b → Lección 078b
- Lección 076 ← Lección 077 → Lección 078