Química/Grupos funcionales
| Para más información, véase el artículo «Grupo funcional» en Wikipedia. |

Se llama grupo funcional al átomo o grupo de átomos que caracteriza a una clase de compuestos orgánicos y determina sus propiedades. Esencialmente el grupo funcional es la parte no hidrocarbonada de la molécula. Define las propiedades características físicas y químicas de las familias de compuestos orgánicos.
Por ejemplo, en los alcoholes que tienen por fórmula general ROH, en la que R es cualquier grupo alquilo, el grupo hidroxilo —OH, es el grupo funcional.

Los grupos funcionales sencillos se forman por la unión de un heteroátomo que es cualquier átomo salvo el carbono y el hidrógeno que forma parte de un compuesto orgánico (halógeno, oxígeno, azufre, nitrógeno, etc) al carbono de un grupo alquilo mediante un enlace sencillo.[1]
- Concepto de radical

Es un agrupamiento de átomos que interviene como una unidad en un compuesto químico y pasa inalterado de unas combinaciones a otras. [2]Se forma en el intermedio de reacciones químicas, a partir de la ruptura de una molécula y, en general, es extremadamente inestable y, por tanto, con gran poder reactivo y de vida media muy corta (milisegundos). En las fórmulas se representan con un punto.
- Radicales según el número de átomos
Pueden ser:
- Monoatómicos, como el radical cloro Cl·, el radical bromo Br·, o el radical hidrógeno H·, que son simplemente átomos o iones con un número impar de electrones.
- Poliatómicos, formados por más de un átomo, como el radical metilo, CH3·
- Radical alquilo
Un radical alquilo es un grupo de átomos inestable derivado de un alcano que ha perdido un átomo de hidrógeno y ha quedado con un electrón desapareado o impar. El radical formado está centrado sobre el átomo de carbono.
Los radicales alquilo se nombran sustituyendo la terminación -ano del hidrocarburo por -ilo. Para representar a un radical cualquiera se emplea el símbolo R. Asi R — CL es un cloruro de alquilo y representa a uno cualquiera de los compuestos tales como CH3 — Cl, cloruro de metilo, C2H5 — Cl cloruro de etilo, etc. También R — OH representa a un alcohol cualquiera como el CH3 — OH metanol.[3]
- Grupo alquilo

El grupo funcional alquilo (nombre derivado de alcano con la terminación de radical -ilo) es un sustituyente, formado por la separación de un átomo de hidrógeno de un hidrocarburo saturado o alcano, para que así el alcano pueda enlazarse a otro átomo o grupo de átomos.
La eliminación de un hidrógeno en el metano, CH4, da lugar a la formación de un grupo metilo (metil) — CH3 y cuando se elimina un hidrógeno del etano, C2H6, el grupo formado es el etilo (etil),— CH2CH3, etc. la terminación ilo se prefiere cuando se considera el radical aislado, mientras que la il se utiliza cuando el radical está unido a una cadena carbonada.[4]
Alcoholes
[editar]| Para más información, véase el artículo «Alcohol» en Wikipedia. |
Un alcohol es un compuesto orgánico que contiene un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno, enlazado de forma covalente a un átomo de carbono. Además este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos.
Los monoalcoholes derivados de los alcanos responden a la fórmula general CnH2n+1OH .
- Nomenclatura
Los alcoholes se dividen en tres clases en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentra enlazado el grupo hidroxilo. Por lo tanto los alcoholes pueden ser primarios, secundarios o terciarios, cuando el átomo de carbono está unido respectivamente a uno, dos o tres átomos de carbono.
-
1-Propanol, alcohol primario
CH3-CH2-CH2OH -
2-Propanol, alcohol secundario
CH3CH(OH)CH3 -
terc-Butanol, alcohol terciario
(H3C)3-C-OH
- Común (no sistemática): anteponiendo la palabra alcohol y sustituyendo el sufijo -ano del correspondiente alcano por -ílico. Así por ejemplo tendríamos:
- alcohol metílico o metanol CH3OH,
- alcohol etílico o etanol CH3-CH2-OH,
- alcohol propílico o propanol CH3-CH2-CH2OH, etc.
-
metanol
-
etanol
- IUPAC: añadiendo una l (ele) al sufijo -ano en el nombre del hidrocarburo precursor (met-ano-l, de donde met- indica un átomo de carbono, -ano- indica que es un hidrocarburo alcano y -l que se trata de un alcohol), e identificando la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo (3-butanol, por ejemplo).
-
Fórmula semidesarrollada del 2-butanol
-
Estructura del 2-propanol(Isopropanol)
- Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi-
- Se utilizan los sufijos -diol, -triol, etc., según la cantidad de grupos OH que tenga en la molécula.
-
Estructura molecular del 2,3-butanodiol
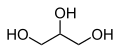
-
1,2,3 propanotriol, un triol
Aldehídos
[editar]| Para más información, véase el artículo «Aldehído» en Wikipedia. |
Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO (formilo). Un grupo formilo es el que se obtiene separando un átomo de hidrógeno del formaldehído. Como tal no tiene existencia libre, aunque puede considerarse que todos los aldehídos poseen un grupo terminal formilo.

Los aldehídos se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al. Etimológicamente, la palabra aldehído proviene del latín científico alcohol dehydrogenatum (alcohol deshidrogenado).
Se nombran sustituyendo la terminación -ol del nombre del hidrocarburo por -al. Los aldehídos más simples (metanal y etanal) tienen otros nombres que no siguen el estándar de la Unión Internacional de Química Pura y Aplicada (IUPAC) pero son más utilizados formaldehído y acetaldehído, respectivamente, estos últimos dos son nombres triviales aceptados por la IUPAC.
Cetonas
[editar]| Para más información, véase el artículo «Cetona» en Wikipedia. |
Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.1 Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendo cetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno.
El tener dos radicales orgánicos unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.
Ácidos carboxílicos
[editar]| Para más información, véase el artículo «Ácido carboxílico» en Wikipedia. |
Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH). En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O). Se puede representar como -COOH ó -CO2H.
Los ácidos carboxílicos tienen como fórmula general R-COOH. Tienen propiedades ácidas; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones una ruptura heterolítica, cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.
Aminas
[editar]| Para más información, véase el artículo «Amina» en Wikipedia. |
Las aminas son compuestos químicos orgánicos que se consideran como derivados del amoníaco y resultan de la sustitución de uno o varios de los hidrógenos de la molécula de amoniaco por otros sustituyentes o radicales. Según se sustituyan uno, dos o tres hidrógenos, las aminas son primarias, secundarias o terciarias, respectivamente.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar puentes de hidrógeno. Las aminas terciarias puras no pueden formar puentes de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos OCNR polar que el enlace O-H. Por lo tanto, las aminas forman puentes de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.
Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin puentes de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes.
Nomenclatura de las aminas
[editar]Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos. Las que tienen un solo grupo se llaman aminas primarias, las que tienen dos se llaman aminas secundarias y las que tienen tres, aminas terciarias.
Las aminas sencillas se nombran enumerando los grupos que sustituyen a los átomos de hidrógeno del amoniaco y terminando con amina. Si hay varios grupos o radicales sustituyentes iguales se usan los prefijos di o tri. Cuando se trata de grupos diferentes estos se nombran por orden alfabético (etil antes que metil, o butil antes que propil, prescindiendo del tamaño) y terminando con la terminación amina.
Amidas
[editar]| Para más información, véase el artículo «Amidas» en Wikipedia. |
Las amidas son derivados de los ácidos carboxílicos. Como sabemos, los ácidos carboxílicos contienen un grupo COOH. En las amidas se sustituye el OH por un grupo R-N-R. Esta amida podría ser primaria, terciaria o secundaria dependiendo de que fueran estos radicales llamados R. Si fueran dos hidrógenos sería una amida primaria. Si fueran un hidrógeno y una cadena sería secundaria y si ambas R fueran cadenas sería una amida terciaria. Los puntos de ebullición de estos compuestos orgánicos varían bastante. En el caso de la metanamida es de 3 grados y en el caso de la etanamida es de 82. Las amidas pueden formar puentes de hidrógenos debido a que son moléculas polares y que contienen nitrógeno y oxígeno. Las amidas pequeñas son solubles en agua por este mismo motivo. [5]