Química/Estereoquímica
La estereoquímica es la rama de la Química que se encarga de estudiar la disposición que adoptan en el espacio los átomos pertenecientes a una molécula.
EL nombre proviene de dos términos, primero el término estéreo que viene del griego “, que significa ‘sólido’, y una palabra ya conocida, Química.
Se refiere al estudio de las moléculas desde el punto de vista espacial.
Dentro de esta rama, es de especial importancia el estudio de los estereoisómeros. Los estereoisómeros son sustancias isomericas que tienen la misma composición y conectividad entre sus átomos pero difieren en cómo estos se ubican en el espacio. Esta disposición diferente puede ocasionar que dos estereoisómeros tengan propiedades distintas o reaccionen en forma diferente.
Una parte importante de la estereoquímica se dedica al estudio de las moléculas quirales.
Simetría en química orgánica
[editar]Elementos y operaciones de simetría
[editar]Un elemento de simetría es una línea, un plano o punto al cual, después de aplicarle una operación de simetría (tal como una rotación o reflexión) nos deja un objeto indistinguible del original.
|
Vamos a considerar cinco operaciones de simetría:
|
Rotación respecto a un eje de simetría (Cn)
[editar]La existencia de un eje de rotación Cn en una molécula implica que al rotar 360/n grados la molécula los átomos estarán en la misma posición que antes de rotarla.
- Por ejemplo, podemos rotar el cis-dicloroeteno 180º por un eje perpendicular al plano del doble enlace que pase por el punto medio del mismo y dejar la molécula inalterada.
El "n" será n=360/180 = 2 por lo que decimos que es un eje de simetría de orden 2.
Cuando en una molécula existe más de un eje decimos que el de mayor orden (mayor "n") es el principal. En caso de existir varios ejes del mismo orden tomaremos como principal el que atraviese la mayor cantidad de átomos.
Identidad (E)
[editar]La operación de identidad consiste en rotar el objeto 360º, por lo que este queda inalterado y correspondería a un eje de rotación C1.
Podemos ver que cualquier objeto posee este elemento de simetría. Diremos que aquellas moléculas a las cuales la única operación que podemos aplicarle es la identidad son asimétricas.
Reflexión respecto de un plano de simetría (σ)
[editar]Cuando en la molécula hay un plano de simetría por cada átomo a un lado del mismo podemos encontrar otro del mismo tipo y en la misma posición y distancia del plano, como si reflejáramos un lado del plano en un espejo.
Cuando en la molécula hay ejes de rotación y planos de simetría podemos analizar la relación que existe entre ellos. Así, diremos que un plano de simetría es vertical y lo designaremos σv cuando contiene al eje de rotación principal. Si un plano es perpendicular al eje de rotación principal diremos que es horizontal (σh). Si el plano es paralelo al eje principal y bisecta el ángulo formado por dos ejes de rotación C2 diremos que es diagonal (σd).
Quiralidad
[editar]Quiralidad
[editar]Se dice que un objeto es quiral si no es superponible con su imagen especular.
El término "quiral" fue introducido por Lord Kelvin.
| Denomino quiral y digo que tiene quiralidad toda figura geométrica, o todo grupo de puntos, si su imagen en un espejo plano, idealmente realizada, no puede hacerse coincidir consigo misma. Lord Kelvin
|
- Tomemos como ejemplo nuestra mano izquierda, la imagen especular de la misma es nuestra mano derecha. Si intentamos superponerlas rápidamente llegaremos a la conclusión de que no es posible, ya que la única forma de hacer coincidir los dedos es rotando 180º una de las dos manos pero ya que el dorso de la mano es distinto de la palma es imposible una mano con la versión girada de la otra.

De hecho, la palabra quiral deriva del griego "cheir" que significa mano.
Un objeto quiral no posee planos de simetría o puntos (centros) de simetría. Un plano de simetría atraviesa el objeto y lo divide en dos de forma tal que la imagen a un lado del plano es la imagen especular (reflexión, como vista en el espejo) de la otra. Es decir, existe una correspondencia punto a punto entre los dos lados del plano; por cada punto ubicado a un lado del plano habrá otro igual, a una misma distancia, del otro lado del plano.
Un punto de simetría (o centro de inversión) se ubica en el objeto de tal forma que cualquier punto puede reflejarse a través de este centro y dejar el objeto intacto.
Todo objeto posee una imagen especular, las moléculas también y por lo tanto pueden clasificarse en quirales o aquirales (no quirales).
La quiralidad es condición necesaria aunque no suficiente para la existencia de actividad óptica.
Centro quiral o estereogénico
[editar]Hay una forma sencilla de predecir si una molécula es o no quiral y consiste en buscar los centros quirales.
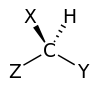
Un centro quiral (o estereogenico) se obtiene cuando un átomo central y otros cuatro átomos o grupos de átomos distintos se unen adoptando una geometría molecular tetraédrica.
- Por ejemplo, un átomo de carbono unido a otros átomos (o grupos de átomos) distintos entre si. Esta molécula, que podemos representar por CHXYZ, no posee un plano ni un centro de simetría y por lo tanto es una molécula quiral. El átomo central no debe ser de carbono necesariamente, existiendo centros quirales sobre átomos de azufre, silicio, etc.
Siempre que una molécula posea un solo centro estereogénico será quiral pero si posee dos o más centros esto no es cierto, existiendo isómeros aquirales (ver formas meso).

Es importante destacar que pueden existir moléculas que aun sin poseer centros estereogenicos pueden ser quirales, por lo que la ausencia de centro quiral no necesariamente indica que el compuesto sea aquiral (para asegurarlo hace falta constatar la ausencia de planos y centros de simetría). Como ejemplo de estas moléculas se encuentran compuestos que tienen la rotación entorno a enlaces sigma C-C impedida (por ejemplo, debido a efectos estéricos o a poseer dobles enlaces), siendo un ejemplo los alenos (dienos acumulados).
Actividad óptica
[editar]Se denomina actividad óptica de un compuesto químico, a la propiedad que tienen ciertas moléculas, de poder rotar el plano de un haz de luz polarizada.
Sólo poseen actividad óptica aquellas moléculas que son quirales, es decir, asimétricas. Debido a la diferente ubicación de los átomos en el espacio, las moléculas quirales interactúan con la luz polarizada en diferente medida, de suerte que dos pares de enantiómeros giran el plano de la luz polarizada en el mismo ángulo pero en diferente sentido (uno a la derecha: dextrógiro, y el otro a la izquierda: levógiro) si están en idéntica concentración en la solución, esta no rotará el plano de la luz polarizada. Los estereoisómeros que guardan otra relación entre sí que no sea la enantiomería, pueden presentar valores de rotación específica sin ninguna relación entre ellos, (La rotación específica de cada sustancia por su concentración, se suma, dando hacia la rotación de la solución problema).
Enantiómeros
[editar]Son isomeros opticos,considerados especulares no superponibles. Poseen propiedades físicas y químicas idénticas, exceptuando la dirección del giro de la luz polarizada.
Diasteroisómeros
[editar]Dos compuestos son diasteroisomericos si, siendo estereoisómeros, no son enantiómeros, es decir, no son imágenes especulares uno del otro.
Un par de diasteroisómeros pueden diferir en sus propiedades físicas y tener distinta reactividad (aun en presencia de reactivos aquirales).
