Formulación inorgánica/Texto completo
edicion de números algebraicos
Introducción
[editar]Ordenación de los elementos
[editar]A los elementos se les da preferencia a la hora de nombrarlos según su electronegatividad, nombrandose primero al menos electronegativo:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F
Prefijos
[editar]Existe un prefijo primario (primera columna) y uno secundario (que refleja cantidad):
- 1 – mono
- 2 – di (bi)
- 3 – tri
- 4 – tetra
- 5 – penta
- 6 – hexa
- 7 – hepta
- 8 – octa
- 9 – ennea o nona
- 10 – deca
- 11 – hendeca o úndeca
- 12 – dodeca
Abreviaturas utilizadas
[editar]- x, y, z – elementos
- α – prefijo numérico griego
- (#) – valencia del elemento en números romanos y entre paréntesis
- δ – prefijo o sufijo tradicional
- γ – prefijo numérico griego de cantidad
Combinaciones binarias del hidrógeno
[editar]Son combinaciones del hidrógeno con otro elemento. Se clasifican en: hidruros metálicos, hidrácidos y aquellos formados por hidrógeno y otros no metales.
Hidruros metálicos
[editar]Son combinaciones del hidrógeno con metales. El hidrógeno actúa con valencia 1 y el metal con cualquiera de sus valencias. Los metales de transición, los lantánidos y los actínidos en general no forman compuestos con el hidrógeno (si lo hacen es por oclusión dentro de las redes)
La formulación de los hidruros se forma situando el símbolo del metal a la izquierda, el del hidrógeno a la derecha e intercambiando las valencias:
- MHx
Nomenclatura de Stock
[editar]Se forma uniendo las palabras hidruro de y el nombre del metal. Se especificaría también la valencia de éste en números romanos y entre paréntesis:
- hidruro de x (#)
Nomenclatura sistemática con prefijos
[editar]Cuando el metal tiene más de una valencia posible, se escribe el prefijo numeral seguido de -hidruro de y el nombre del metal:
- αhidruro de x es parte de los más básicos metales en sus compuestos binarios
Ejemplos:
| Formulación | Nomenclatura Stock | Nomenclatura sistemática con prefijos |
|---|---|---|
| LiH | hidruro de litio | hidruro de litio |
| NaH | hidruro de sodio | hidruro de sodio |
| CsH | hidruro de cesio | hidruro de cesio |
| FeH2 | hidruro de hierro (II) | dihidruro de hierro |
| FeH3 | hidruro de hierro (III) | trihidruro de hierro |
Hidrácidos
[editar]exceptuando el Oxígeno. Se combinan usando la valencia negativa: el -1 para los primeros y el sus valencias:
- HxNm.
Nomenclatura sistemática
[editar]Se nombran en cualquier estado añadiendo a la raíz del elemento la terminación -uro de, y después la palabra hidrógeno. Dependiendo de como está el compuesto se escribe, ejemplo:
-Con 1= HF: Fluoruro de hidrógeno.
-Con 2= H2S: Sulfuro de dihidrógeno.
Específicamente cuando están en disolución acuosa se nombran añadiendo la palabra ácido y la raíz del compuesto con la terminación -hídrico.
- ácido x-hídrico
Véase:
| Fórmula | Nomenclatura Stock | Nomenclatura tradicional | Nomenclatura sistemática |
|---|---|---|---|
| HF | fluoruro de hidrógeno | ácido fluorhídrico | fluoruro de hidrógeno |
| HCl | cloruro de hidrógeno | ácido clorhídrico | cloruro de hidrógeno |
| HBr | bromuro de hidrógeno | ácido bromhídrico | bromuro de hidrógeno |
| HI | yoduro de hidrógeno | ácido yodhídrico | yoduro de hidrógeno |
| H2S | sulfuro de hidrógeno | ácido sulfhídrico | sulfuro de dihidrógeno |
| H2Se | seleniuro de hidrógeno | ácido selenhídrico | seleniuro de dihidrógeno |
| H2Te | telururo de hidrógeno | ácido telurhídrico | telururo de dihidrógeno |
Hidrógeno con otros no metales
[editar]Son las combinaciones que no son ácidas del hidrógeno con no metales de los grupos VA (N, P, As, Sb, Bi), IVA (C, Si) y IIIA (B).
Su formulación es inversa a la de los hidrácidos: a la izquierda el símbolo del no metal, a la derecha el hidrógeno y se intercambian las valencias:
- NmHx
Nomenclatura sistemática
[editar]Se utiliza un prefijo numeral seguido de la raíz -hidruro de y el nombre del no metal:
- αhidruro de x
Nomenclatura tradicional
[editar]Todas estas combinaciones tienen un nombre común.
| Fórmula | Nomenclatura sistemática | Nomenclatura tradicional |
|---|---|---|
| NH3 | trihidruro de nitrógeno | amoniaco |
| PH3 | trihidruro de fósforo | fosfina |
| AsH3 | trihidruro de arsénico | arsina |
| SbH3 | trihidruro de antimonio | estibina |
| BiH3 | trihidruro de bismuto | bismutina |
| CH4 | tetrahidruro de carbono | metano |
| SiH4 | tetrahidruro de silicio | silano |
| B2H6 [1] | hexahidruro de diboro | diborano |
- ↑ Es una excepción, en la naturaleza se encuentra en forma de dímeros. El monómero, BH3, borano, no tiene existencia como compuesto libre y sólo se ha detectado de forma momentánea en la descomposición térmica del diborano.
Combinaciones binarias del oxígeno
[editar]Son las combinaciones del oxígeno con otro elemento. Se clasifican en óxidos, peróxidos, hiperóxidos y ozónidos.
Óxidos
[editar]Son combinaciones del oxígeno con cualquier otro elemento. El oxígeno actúa con valencia 2 y el otro elemento con cualquiera de sus valencias posibles.
Su formulación se compone del símbolo del elemento a la izquierda, el oxígeno a la derecha y se intercambian las valencias:
- E2Ox
Se simplificarán las valencias siempre que sea posible:
- C2O2 → CO
Nomenclatura de Stock
[editar]Se forma usando las palabras óxido de seguidas del nombre del elemento. En caso de que se puedan combinar con más de una valencia también se especificará la valencia en números romanos entre paréntesis.
- óxido de X (#)
Nomenclatura antigua
[editar]Si el oxígeno se combina con un metal se utiliza la palabra óxido seguida de la raíz del elemento con el sufijo:
- –oso para la valencia más pequeña
- –ico para la valencia más grande
óxido Xsufijo
Pero si el oxígeno se combina con un no-metal se utiliza la palabra anhídrido seguida de la raíz del elemento con los prefijos y sufijos:
- hipo- ... –oso para la valencia más pequeña
- ... –oso para la valencia pequeña
- ... –ico para la valencia grande
- per- ... –ico para la valencia más grande
anhídrido Xsufijo
Nomenclatura sistemática con prefijos
[editar]Es poco utilizada y no está recomendada. Se forma usando un prefijo numeral seguido de la raíz –óxido de, un segundo prefijo numeral y el nombre del elemento. El segundo prefijo se utiliza sólo si hay más de una valencia posible:
- αóxido de αX
Excepciones
[editar]En todos los óxidos, el oxígeno es el elemento más electronegativo y, por lo tanto, se escribe en la fórmula a la derecha. Pero cuando el oxígeno se combina con el flúor, este último es el más electronegativo, por lo que se escribe a la derecha del oxígeno y el compuesto se nombra como un fluoruro:
OF2, fluoruro de oxígeno, difluoruro de oxígeno, fluoruro de oxígeno
| Formulación | Nomenclatura de Stock | Nomenclatura sistemática | Nomenclatura antigua |
|---|---|---|---|
| FeO | óxido de hierro (II) | monóxido de hierro | óxido ferroso |
| Fe2O3 | óxido de hierro (III) | trióxido de dihierro (sesquióxido de hierro) | óxido férrico |
| Cl2O | óxido de cloro (I) | monóxido de dicloro | anhídrido hipocloroso |
| Cl2O3 | óxido de cloro (III) | trióxido de dicloro | anhídrido cloroso |
| Cl2O5 | óxido de cloro (V) | pentóxido de dicloro | anhídrido clórico |
| Cl2O7 | óxido de cloro (VII) | heptóxido de dicloro | anhídrido perclórico |
^^
Peróxidos
[editar]Compuestos binarios, generalmente iónicos, que forma el con algunos metales, principalmente de los grupos y . Se caracterizan por la presencia del (ión peróxido).
El peróxido solo es estable con la mayor valencia del metal.
Formulacion directa
[editar]Tradicional:
Ejemplos:
(Peróxido de Cobre)
(Peróxido de Hierro)
No se simplifica ya que se debe mantener la estructura del (ión peróxido).
Nomenclatura
[editar]- Tradicional:
es el elemento en cuestión
Ejemplos:
Peróxido de Sodio (Oxilita)
Peróxido de Hidrógeno ( en disolución acuosa se conoce como "Agua oxigenada")
Peróxido de Bario
Hiperóxidos
[editar]Son óxidos cuyo oxígeno se ha sustituido por un grupo hiperóxido (O-2). Se forman añadiendo el prefijo hiper- al nombre del óxido.
hiperóxido de x (#)
Ejemplos:
KO2 hiperóxido de potasio NaO2 hiperóxido de sodio
Ozónidos
[editar]Son óxidos cuyo oxígeno se ha sustituido por un grupo ozono (O-3). Se forman sustituyendo la palabra óxido por ozónido:
- Ozónido de x (#)
Ejemplos:
- KO3 ozónido de potasio
- RbO3 ozónido de rubidio
- CsO3 ozónido de cesio
Otras combinaciones binarias
[editar]No metales con metales
[editar]Nomenclatura estequiométrica
[editar]Se forma, siendo “x” un no metal y “y” un metal:
αx-uro de αy
Ejemplos:
CuBr monobromuro de cobre Mg3N2 dinitruro de trimagnesio
Nomenclatura de stock
[editar]Se forma, siendo “x” un no metal e “y” un metal:
x-uro de y (#)
Ejemplos:
CuBr bromuro de cobre (I) Mg3N2 nitruro de magnesio
Nomenclatura antigua
[editar]Se forma, siendo “x” un no metal y “y” un metal:
x-uro y-δ
Ejemplos:
CuBr bromuro cuproso Mg3N2 nitruro magnésico
No metales con no metales
[editar]Nomenclatura estequiométrica
[editar]Se forma, siendo “x” el elemento más electronegativo y “y” el más electropositivo:
αx-uro de αy
Ejemplos:
BP monofosfuro de boro CS2 disulfuro de carbono
Nomenclatura de Stock
[editar]Se forma, siendo “x” el elemento más electronegativo y “y” el más electropositivo:
x-uro de y (#)
Ejemplos:
BP fosfuro de boro CS2 sulfuro de carbono NCl3 cloruro de nitrógeno(III)
Hidróxidos
[editar]Utilizamos el grupo OH como si fuese un elemento de valencia 1.
Nomenclatura de Stock
[editar]Se forman según la fórmula:
hidróxido de x (#)
Ejemplos:
LiOH hidróxido de litio
Cr(OH)2 hidróxido de cromo (II)
Nomenclatura sistemática
[editar]Se forman de la siguiente forma:
α-hidróxido de x
Ejemplos:
LiOH hidróxido de litio
Cr(OH)2 dihidróxido de cromo
Ácidos con enlaces carbono-nitrógeno
[editar]Estos son:
HCN → H - C ≡ N ácido cianhídrico (hidrácido) HOCN → H - O - C ≡ N ácido ciánico HNCO → H - N = C = O ácido isociánico HCNO → H - C ≡ N+ - O- ácido fulmínico
Ácidos oxoácidos
[editar]Nomenclatura sistemática funcional
[editar]Se forma, siendo el prefijo griego el número de oxígenos (entre paréntesis indica el número de polimerización, si se da el caso):
ácido α-oxo-(α)-x-ico (#)
Ejemplos:
H2SO4 ácido tetraoxosulfúrico (VI) H4SiO4 ácido tetraoxosilícico
Nomenclatura sistemática
[editar]Se forma, siendo el prefijo griego el número de oxígenos, (entre paréntesis indica el número de polimerización, si se da el caso):
α-oxo-(α)x-ato (#) de hidrógeno
Ejemplos:
H2SO4 tetraoxosulfato (VI) de hidrógeno H4SiO4 tetraoxosilicato de hidrógeno
Nomenclatura tradicional
[editar]Para nombrar a los compuestos utilizaremos los sufijos y prefijos griegos, en el caso de un elemento que tiene dos valencias:
-oso, para la menor valencia del elemento. -ico, para la mayor valencia del elemento.
Para los elementos que tienen cuatro estados de oxidación, utilizamos también los prefijos:
hipo- -oso, para la menor de las valencias del elemento -oso, para la segunda menor -ico, para la segunda mayor per- -ico, para la mayor de las valencias del elemento
se utilizan según la fórmula:
ácido δ-x-δ
Cuando el elemento presenta un número de oxidación distinto a dos o a cuatro puede adoptar nomenclaturas tradicionales especificas, estos elementos son S, N, y P
Los nombres específicos son:
Azufre (S):
H2SO2 (+2) ácido sulfoxílico
HSO2 (+3) ácido tionoso
HSO3 (+5) ácido tiónico
Nitrógeno (N):
H2N2O2 (+1) ácido hiponitroso
H2NO2 (+2) ácido nitroxílico
Fósforo (P):
H3PO2 (+1) ácido hipofosforoso (ácido fosfínico)
H3PO3 (+3) ácido fosforoso (ácido fosfónico)
H3PO4 (+5) ácido fosfórico
Prefijos fundamentales:
- meta- y orto-: hacen referencia al contenido en moléculas de agua del ácido oxácido
meta- hace referencia a un contenido menor en agua orto- hace referencia a un mayor contenido en agua
a la hora de formular, un componente que contiene el prefijo orto- significa que se le ha añadido una molécula de agua al ácido correspondiente, excepto en el caso de los elementos I y Te que se les añade dos moléculas de agua.
Cuando nombramos los elementos P, As, Si, y B sin ningún prefijo fundamental, estamos haciendo referencia a la forma orto-, y si deseamos poner la forma meta, deberemos hacer referencia a ella.
Ejemplo:
HAsO3 ácido metaarsénico
- di- o piro-, tri-, tetra, ...: indican el grado de polimerización del ácido. El prefijo di- indica que el ácido se forma quitando una molécula de agua a dos moléculas del ácido.
Como regla general, se elimina una molécula de agua menos que el número que indica el grado de polimerización del ácido.
Ejemplo:
2H2SO4 - 1H2O → H2S2O7
Cationes
[editar]Cationes monoatómicos
[editar]Nomenclatura sistemática
[editar]Se forma:
ion x (#)
Ejemplos:
Li+ ion litio Cu+ ion cobre (I)
Nomenclatura tradicional
[editar]No es aceptada por la IUPAC, se forma con los prefijos:
- oso: para la menor valencia - ico: para la mayor valencia
se utilizan según la fórmula:
ion x-δ
Ejemplos:
Li+ ion litio Cu+ ion cuproso
Cationes poliatómicos
[editar]En ambas nomenclaturas se les nombra por ion ... a los metales y por catión ... a los no metales.
Nomenclatura tradicional modificada
[editar]Se forma según la fórmula:
ion/catión x-ilo (#)
Ejemplos:
VO+ ion vanadilo (III) VO2+ ion vanadilo (IV) VO3+ ion vanadilo (V)
Existen dos elementos que posen nomenclatura propia:
NO+ catión nitrosilo NO+2 catión nitroílo SO2+ catión sufinilo o tionilo SO2+2 catión sulfonilo o sulfurilo ¿?¿? ion vanadilo (V): VO3+ o VO3+2
Nomenclatura sistemática
[editar]Se forma, siendo α el número de átomos de oxígeno:
ion/catión α-oxo-x (#)
Ejemplos:
VO2+ ion monooxovanadio (IV) SO2+2 ion dioxoazufre (VI)
Especies cargadas
[editar]Se forma de la siguiente manera:
ion x-onio
Existe una excepción: La especie cargada procedente del agua:
H3O+ ion oxonio
Ejemplos:
NH+4 ion amonio Sb+4 ion estibonio H2I+ ion yodonio
Aniones
[editar]Aniones monoatómicos
[editar]Se forman de la siguiente manera:
ion x-uro
Ejemplos:
H- ion hidruro D- ion deuteruro Br- ion bromuro
Aniones poliatómicos
[editar]Está el más común es el ion hidroxilo (OH-), pero la gran mayoría proceden de los ácidos que han perdido sus hidrógenos.
Nomenclatura tradicional
[editar]Se forman, exclusivamente, cambiando las terminaciones al ácido del que proceden:
-oso a ito -ico a ato
según la fórmula:
ion x-δ
Ejemplos:
ClO- ion hipoclorito (Cr2O7)2- ion dicromato
Nomenclatura sistemática
[editar]Procede de la nomenclatura sistemática de ácidos, se forman suprimiendo la palabra “de hidrógeno” y añadiendo la palabra “ion”. Sería, siendo el prefijo griego el número de oxígenos, (α entre paréntesis indica el número de polimerización, si se da el caso) la siguiente fórmula:
ion α-oxo-(α)x-ato (#)
Ejemplos:
ClO- ion monooxoclorato (I) (Cr2O7)2- ion heptaoxodicromato (VI)
Isopolianiones
[editar]Son aniones derivados de ácidos de naturaleza polimérica, además de la nomenclatura sistemática ya tratada, existe otra nomenclatura llamada de Ewens-Bassett, que es exactamente igual, pero que cambia el número de la valencia por el número de cargas.
Ejemplos:
P3O5-10 ion decaoxotrifosfato (V) ion decaoxotrifosfato (5-) Mo7O6-24 ion 24-oxoheptamolibdato (VI) ion 24-oxoheptamolibdato (6-) V3O3-9 ion enneaoxotrivanadato (V) ion enneaoxotrivanadato (3-)
Oxosales
[editar]Se forman en ambas nomenclaturas de la siguiente manera, siendo “x” el anión y “y” el catión:
x de y
Ejemplos:
NaClO4 perclorato de sodio tetraoxoclorato (VII) de sodio K2SO3 sulfito de potasio trioxosulfato (IV) de potasio
Peroxoácidos
[editar]Son ácidos en los que hay un grupo peroxo en lugar de un oxígeno:
 Ácido sulfúrico
Ácido peroxosulfúrico Ácido peroxosulfúrico
Ácido sulfúrico
Ácido peroxosulfúrico Ácido peroxosulfúrico
Nomenclatura tradicional
[editar]Consiste en añadir el prefijo peroxo- al ácido del que proceda, es decir, siendo “x” el ácido de procedencia:
ácido peroxo-x
Ejemplos:
H2SO5 o H2SO3(O2) ácido peroxosulfúrico HNO3 o HNO2(O2) ácido peroxonitrico
Nomenclatura sistemática
[editar]Se menciona el grupo peroxo aparte, el resto de la molécula se trata de la forma usual
Ejemplos: Nombre sistematico funcional Nombre sistematico
H2SO5 ácido trioxoperoxosulfúrico (VI) trioxoperoxosulfato(VI) de H H2S2O8 ácido hexaoxoperoxodisulfúrico(VI) hexaoxoperoxodisulfato de H HNO4 ácido dioxoperoxonítrico (V) dioxoperoxonitrato(V) de hidrógeno
Óxidos dobles
[editar]Son óxidos de distinta carga alternados. Se forman según la fórmula:
α-óxido (doble) de α-x (#) - α-y (#)
α numera a cada elemento. Los elementos tanto en la fórmula como en el nombre se escriben en orden alfabético, sin tener en cuenta el prefijo griego.
Ejemplos:
FE3O4 ≡ FeO · Fe2O3 tetraóxido (doble) de hierro (II) – dihierro (III) K2MgO2 dióxido (doble) de magnesio – dipotasio AuKO2 dióxido (doble) de oro (III) – potasio
Hidróxidos dobles
[editar]Son similares a los óxidos dobles. Se forman:
α-hidróxido (doble) de α-x (#) - α-y (#)
Ejemplos:
AlCa2(OH)7 ≡ Al(OH)7 · 2 Ca(OH)2 heptahidróxido (doble) de aluminio – dicalcio Rb2Sn(OH)6 hexahidróxido (doble) de estaño(IV) – dirubidio
Sales dobles,triples..
[editar]Cuando en una sal hay varios cationes, se escriben y citan en orden alfabético.
x (doble, triple...) de αy (#)-αz (#)-...-αn (#)
Siendo “x” el anión, y “y” y “z” los cationes.
Ejemplos:
AgK(NO3)2 nitrato (doble) de plata-potasio CuK2Mg2(P2O7)2 difosfato (triple) de cobre (II)-dimagnesio-dipotasio
Si hay hidrógenos “ácidos”, estos se escriben y nombran como habitualmente se hace.
Ejemplos:
LiNaHPO4 hidrogenofosfato (doble) de litio-sodio CsNH4HPO3 hidrogenofosfonato (doble) de amonio-cesio
Si la sal contiene varios aniones, también debe seguirse con ellos un orden alfabético, anotando también si se repite el anión con los prefijos griegos. Siendo x,y,n aniones y z cationes.
γx-γy-...-γn de z
Ejemplos:
BaBrCl bromuro-cloruro de bario SrClF cloruro-fluoruro de estroncio Al2(NO3)4(SO4) tetrakis(nitrato)-sulfato de aluminio
Sales ácidas
[editar]Son sales, cuyos ácidos de los que proceden no han perdido todos sus hidrógenos.
Nomenclatura sistemática
[editar]Se forma:
γ [α-hidrógeno-α-oxo-x (#)] de y (#)
siendo:
γ - prefijo griego que indica la repetición de un anión poliatomico α1 - el número de hidrógenos
(anión)
α2 - el número de oxígenos x - elemento del anión (#) - valencia de x
(catión)
y - elemento del catión (#) - valencia de y
Ejemplos:
NaHSO4 hidrogenotetraoxosulfato (VI) de sodio Al(H2PO4)3 tris[dihidrogenotetraoxofosfato (V)] de aluminio
Nomenclatura IUPAC
[editar]Se forma añadiendo a la nomenclatura tradicional de aniones el prefijo hidrógeno precedido por un prefijo griego (α) que indica el número de átomos de hidrógeno, (siendo “x” el nombre del anión y “y” el nombre del catión):
α-hidrogeno-x de y (#)
Ejemplos:
NaHSO4 hidrogenosulfato de sodio Al(H2PO4)3 dihidrogenofosfato de aluminio
Nomenclatura tradicional
[editar]Según algunos autores es una nomenclatura incorrecta, se forma:
α-bi-x α-y-δ
siendo α1 el número de veces que se repite el anión y α2 el número de veces que se repite el catión, el catión se nombra de forma tradicional
Oxisales
[editar]Son una agrupación de un óxido con una sal. Se nombran como sales dobles, siendo “x” el nombre del anión y “y” el nombre del catión. Véase la fórmula:
α-oxi-x de y (#)
Ejemplos:
Hg4(CO3)O3 trioxicarbonato de mercurio (II) Bi2(Cr2O7)O2 dioxidicromato de bismuto (III)
Hidroxisales
[editar]Son sales dobles que contienen el ion hidróxido junto a otros aniones. Se nombra indicando el número de iones hidróxido que contiene:
α-hidroxi-x de y (#)
Ejemplos:
Cu2Cl(OH)3 trihidroxicloruro de cobre (II) Al2(OH)4(SO4) tetrahidroxisulfato de aluminio
Tioderivados
[editar]Surgen de la sustitución de un oxígeno por un azufre. Se nombran, siendo “x” el ácido del que procede, de la siguiente manera:
ácido αtio-fosforico
Ejemplos:
H3PO3S ácido monotiofosfórico H3PO2S2 ácido ditiofosfórico H3POS3 ácido tritiofosfórico
Si en lugar de azufre hay selenio o teluro, se usan los prefijos seleno- o teluro- de igual manera:
H2SO3Se ácido monoselenosulfúrico
Derivados funcionales de los ácidos
[editar]Consiste en la sustitución de un grupo hidroxilo (OH) de un ácido por un halógeno, una amida... Se forman de la siguiente manera, siendo “x” el compuesto añadido y “y” el nombre del ácido:
ácido α-x-y
Ejemplos:
Ácido clorosulfúrico Ácido clorosulfúrico
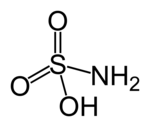 Ácido amidosulfúrico
Ácido amidosulfúrico
Nomenclatura del ión complejo
[editar]Primero se nombran los ligandos teniendo en cuenta las siguientes reglas:
- Los ligandos aniónicos se citan como tales aniones, ejemplos: H-: hidruro, HSO-3: hidrogenosulfito... Sin embargo, hay unos cuantos aniones a los que se dan nombres algo modificados:
F- fluoro O2- oxo S2- tio Cl- cloro OH- hidroxo CN- ciano Br- bromo O2-2 peroxo C2O2-4 (ox) oxalato I- yodo HS- mercapto (en)2- etilendiamino
(EDTA)2- etilendiaminotetraacetato (6 átomos donadores)
- Para citar los ligandos neutros o catiónicos se utiliza su nombre conocido a excepción de los ligandos:
H2O acuo NH3 amino
- Los grupos NO (nitrosilo), CO (carbonilo) y NH3 (amino) se consideran ligandos neutros.
- Los prefijos griegos no se tienen en cuenta a la hora de ordenar alfabéticamente los ligandos. Cuando el ligando tiene por si mismo un prefijo griego se utilizan los prefijos γ (bis, tris...)
- Finalmente, cuando ya se han nombrado todos los ligandos, se cita el átomo central:
- Si se trata de un ion complejo aniónico, añadiendo a la raíz característica del átomo central la terminación –ato e indicando el estado de oxidación de dicho átomo central entre paréntesis y con números romanos:
Ejemplo:
[Fe(H2O)(CN)5]2- ion acuopentacianoferrato (III)
- Si se trata de un ion complejo neutro o catiónico, no se añade ningún sufijo al nombre del átomo central.
Ejemplos:
[Ni(CO)4] tetracarboniloniquel (0) [Fe(H2O)6]2+ ion hexaacuohierro (II)
- Hay algunos ligandos que son capaces de unirse al átomo central de dos formas distintas. Los dos ejemplos más significativos son el [NO2]- y el [SCN]-. El primero puede unirse a través del oxígeno (-ONO, ion nitrito) o a través del nitrógeno (- NO2 ); en este último caso se llama nitro. El [SCN]- puede unirse por el azufre o por el nitrógeno; si se enlaza por el azufre lo llamamos ion tiocianato (-SCN); si se enlaza por el nitrógeno (-NCS) se le llama isotiocianato.
Ejemplos:
[CoBr2(en)2]Cl cloruro de dibromobis(etilendiamino)cobalto (III) [Pt(NH3)4][PtCl6] hexacloroplatinato (IV) de tetraaminoplatino (II) K4[Ni(CN)2(ox)2] dicianodioxalatoniquilato (II) de potasio
Compuestos de coordinación
[editar]Un compuesto de coordinación es una especie neutra que contiene uno o más iones complejos. Los metales de transición tienen una tendencia particular a formar iones complejos, que a su vez se combinan con otros iones o iones complejos para formar compuestos de coordinación.
Las moléculas o iones que rodean al metal en un ion complejo se denominan ligantes o ligandos.
El átomo de un ligando unido de manera directa al átomo del metal “central” se llama donador y el número de átomos donadores que rodean al átomo del metal “central” en un ion complejo se define como número de coordinación.
Los iones complejos pueden ser catiónicos, aniónicos o neutros, según la carga resultante de la especie.
Formulación
[editar]También pueden ser los iones moleculares y por medio de los enlaces covalentes.
Para escribir la fórmula de los iones complejos se coloca en primer lugar el símbolo del átomo o ion central y a su derecha se van anotando los ligandos, siguiendo un orden alfabético basado en los nombres de los correspondientes ligandos.
Nomenclatura
[editar]Los iones complejos aniónicos y catiónicos se aíslan en forma de sales. Estas sales se nombran como tales, pero con la peculiaridad de que aquí el anión o el catión (o ambos) son los iones complejos. Es decir:
anión de catión
Ejemplos:
K3[Fe(CN)6] Hexacianoferrato (III) de potasio [Co(NH3)4Cl2]Cl Cloruro de tetraaminodiclorocobalto (III)













