Disolventes en la Industria Química/Alcoholes


Introducción
[editar]Los alcoholes son compuestos orgánicos que contienen un grupo hidroxilo (-OH), que se encuentra unido a una cadena hidrocarbonada a través de un enlace covalente a un átomo de carbono con hibridación sp3, además este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos; esto diferencia a los alcoholes de los fenoles.

Una clase importante de alcoholes son los alcoholes acíclicos simples , la fórmula general es CnH2n+1OH . De éstos, etanol (C2H5OH) es el alcohol que se encuentra en las bebidas alcohólicas ; en el lenguaje común la palabra alcohol se refiere a etanol.
Según la IUPAC el sufijo "ol" aparecerá en el nombre de todas las sustancias en las que el grupo hidroxilo sea el grupo funcional con la prioridad más alta; en sustancias donde esté presente un grupo de mayor prioridad se utilizará el prefijo "hidroxi". El sufijo "ol" en nombres no sistemáticos (como el paracetamol o el colesterol) también indica normalmente que la sustancia incluye un grupo funcional hidroxilo. Sin embargo, muchas sustancias, en particular azúcares (ejemplos de glucosa y sacarosa) contienen grupos funcionales hidroxilo sin utilizar el sufijo.
Metanol
[editar]
El metanol, también conocido como alcohol metílico, alcohol de madera, nafta de madera o espíritu de madera, es un producto químico con fórmula CH3OH (a menudo abreviado MeOH). El metanol adquirió el nombre de "alcohol de madera", ya que se obtenía principalmente como un subproducto de la destilación destructiva de la madera. El metanol se trata de un alcohol que se sintetiza mediante un proceso catalítico a partir de monóxido de carbono e hidrógeno. Esta reacción emplea altas temperaturas y presiones, y necesita reactores industriales grandes y complicados.«Obtención de metanol». Algunas de sus características principales son:
- Punto de ebullición: 337,8K (65ºC)
- Viscosidad: 0,59 mPa•s (20ºC)
- Solubilidad en agua: totalmente miscible
Es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehído. También se emplea como anticongelante en vehículos, combustible, solvente de tintas, tintes, resinas, adhesivos, biocombustibles y aspartamo. El metanol puede ser también añadido al etanol para hacer que éste no sea apto para el consumo humano y para vehículos de modelismo con motores de combustion interna.
En cuanto a la peligrosidad, su punto de inflamación está en 285K (12ºC), y su temperatura de autoignición en 658K (385ºC), por lo que es inflamable a temperaturas no muy elevadas, pero se necesita una alta temperatura para que arda espontáneamente.
La acción tóxica del metanol viene dada por su oxidación metabólica en ácido fórmico o formaldehído. El metanol tiene una alta toxicidad en los seres humanos. La ingesta de tan solo 10 ml de metanol puro puede causar ceguera permanente por la destrucción del nervio óptico, y 30 mL son potencialmente mortales, aunque la dosis letal media es típicamente 100 ml, es decir, 1-2 ml/kg de peso corporal de metanol puro. Dosis de referencia para el metanol es de 0,5 mg/kg/día.
Etanol
[editar]
El etanol, también llamado alcohol etílico o alcohol puro, es un líquido volátil, inflamable, incoloro, con fórmula CH3CH2OH estructural, a menudo abreviado como C2H5OH o C2H6O. El etanol es una droga psicoactiva y es una de las drogas recreativas más antiguas todavía vigentes en los seres humanos. El etanol puede causar intoxicación por alcohol cuando se consume. Mejor conocido como el tipo de alcohol que se encuentra en las bebidas alcohólicas, que también se utiliza en los termómetros, como disolvente, y como combustible. El tiene una fórmula molecular de C2H6O. Se trata de un alcohol que desde la antigüedad se obtenía por fermentación anaeróbica de una disolución con contenido en azúcares y posterior destilación. Para obtener etanol libre de agua se aplica la destilación azeotrópica en una mezcla con benceno o ciclohexano. Otro método de purificación muy utilizado actualmente es la absorción física mediante tamices moleculares. Algunas de sus características principales son:
- Punto de ebullición: 351,6K (78ºC)
- Viscosidad: 1,074 mPa•s (20ºC)
- Solubilidad en agua: miscible
Se utiliza en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos. Es un buen disolvente, y puede utilizarse como anticongelante. También es un buen desinfectante. La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico, etc.
En cuanto a la peligrosidad, su punto de inflamación está en 286K (13ºC), y su temperatura de autoignición en 636K (363ºC), por lo que es inflamable a temperaturas no muy elevadas, pero se necesita una alta temperatura para que arda espontáneamente.
La exposición prolongada a concentraciones superiores a 5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor,fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. El alcohol no oxidado se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. Su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto. Se trata de un disolvente tóxico, afecta al sistema nervioso central.
Propanol
[editar]
El propanol es un alcohol primario con fórmula C3H8O. Este líquido incoloro es también conocido como propan-1-ol, alcohol 1-propílico, alcohol n-propilo, n-propanol, o simplemente propanol. Es un isómero de isopropanol (2-propanol, alcohol isopropílico). Se forma naturalmente en pequeñas cantidades durante muchos procesos de fermentación y se utiliza como un disolvente en la industria farmacéutica principalmente para resinas y ésteres de celulosa. El propanol se obtiene de diversas maneras. Se forma como producto secundario en la síntesis de metanol. Actualmente se prepara en gran cantidad por oxidación parcial de mezclas propano-butano. Al mismo tiempo se forman otros productos, como aldehidos, metanol, isopropanol, butanoles y otros, de los cuales se separa por destilación. Algunas de sus características principales son:
- Punto de ebullición: 370,3K (97ºC)
- Viscosidad: 2,26cP
- Solubilidad en agua: miscible
Se utiliza en compuestos anticongelantes, solvente para gomas, lacas, hule, aceites esenciales, creosota. Componente en aceites y tintas de secado rápido. En productos cosméticos como son lociones y productos refrescantes. En la limpieza de aparatos electrónicos. En la fabricación de acetona, glicerina, acetato de isopropilo. En medicina como antiséptico.
En cuanto a la peligrosidad, su punto de inflamación está en 288K (15ºC), y su temperatura de autoignición en 623K (350ºC), por lo que es inflamable a temperaturas no muy elevadas, pero se necesita una alta temperatura para que arda espontáneamente. Tiene baja toxicidad, pero produce efectos a corta y larga exposición, en sistema nervioso central, sistema respiratorio y piel.
El propanol es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. Irrita las mucosas y deprime el sistema nervioso central. Cuando se inhala, produce una leve irritación del aparato respiratorio y ataxia. Es algo más tóxico que el isopropanol, pero aparentemente provoca los mismos efectos biológicos.
Isopropanol
[editar]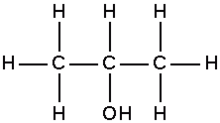
El isopropanol es un compuesto químico con fórmula molecular C3H8O o C3H7OH. Es un compuesto químico incoloro e inflamable con un olor fuerte. Es el ejemplo más simple de un alcohol secundario. Es un isómero estructural de propanol. Se encuentra en estado líquido y se obtiene por hidratación del propileno o por hidrogenación de la acetona.
Algunas de sus características principales son:
- Punto de ebullición:355 K (82ºC)
- Viscosidad: 2,08 cP (298K)
- Solubilidad en agua: muy miscible
Mezclado con agua se usa para limpieza de lentes ópticas, contactos de aparatos electrónicos, etc. También se usa para la síntesis orgánica, como intermediario químico y para disolver compuestos orgánicos como ceras o resinas.
En cuanto a la peligrosidad, su punto de inflamación está en 285K (12ºC), y su temperatura de autoignición en 736K (456ºC), por lo que es inflamable a temperaturas relativamente bajas, pero se necesita mucha temperatura para que arda espontáneamente. El isopropanol tiene una baja toxicidad, es menos irritante que el alcohol etílico, por lo que se puede sustituir por él como antiséptico con los mismos resultados. El isopropanol se metaboliza en el organismo dando acetona, que puede alcanzar concentraciones elevadas, y a su vez, es metabolizada y es excretada por los riñones y los pulmones. En el ser humano, concentraciones de 400 ppm producen irritación leve de ojos, nariz y garganta.
Butanol
[editar]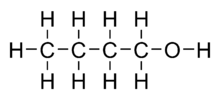
El butanol tiene una fórmula molecular de C4H10O. Se trata de un alcohol primario, que se encuentra naturalmente como subproducto de la fermentación de azúcares e hidrocarburos. Se trata de un petroquímico generalmente usado cerca de donde se produce (a partir del propileno)
Algunas de sus características principales son:
- Punto de ebullición:390.88 K (118ºC)
- Viscosidad: 2,99 cP (298K)
- Solubilidad en agua: 79g/L de agua
Su principal uso es como intermediario industrial para la fabricación de acrilato de butilo. También se usa como saborizante artificial en EEUU en alimentos como la manteca, la crema, el ron, el helado o el caramelo.
En cuanto a la peligrosidad, su punto de inflamación está en 303K (30ºC), y su temperatura de autoignición en 413K (140ºC), por lo que se trata de un líquido inflamable, y para arder de forma espontánea no necesita tanta temperatura como los anteriores. Se trata de un compuesto muy irritante para los ojos y también para la piel en períodos de contacto prolongados. La inhalación de vapores afectaría al SNC (sistema nervioso central) y tracto respiratorio.
El butanol es potencialmente más tóxico que su homólogos inferiores, pero los riesgos prácticos asociados a su producción industrial y su uso a temperatura ambiente son muy pequeños debida a su escasa volatilidad. Las altas concentraciones de vapor producen narcosis y muerte en los animales. La exposición del ser humano a los vapores puede causar irritación de las mucosas. Las concentraciones que producen irritación varían entre 50 y 200 ppm. Con más de 200 ppm pueden presentarse edema leve transitorio ocular. El contacto del líquido con la piel provoca irritación, dermatitis y absorción.
Referencias
[editar]- [1] Vale A (2007). "Methanol". Medicine 35 (12): 633–4.
- [2] "Methanol Poisoning Overview". Antizol.
- https://en.wikipedia.org/wiki/Alcohols
