Física/Estructura de la materia/Estructura intermolecular
Teoría atómica
[editar]El paradigma científico actual sobre la constitución de la materia es la Teoría Atómica, según la cual los átomos son las partículas o corpúsculos más pequeños en que se puede dividir la materia ordinaria.
El átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como núcleones, alrededor del cual se encuentra una nube de electrones de carga negativa.
Moléculas
[editar]
Los átomos se combinan para formar moléculas, cuyos átomos constituyentes se mantienen unidos por las denominadas fuerzas intermoleculares, que provienen de las fuerzas electromagnéticas residuales entre los protones y electrones de los átomos y son el fundamento de los enlaces químicos.
Dado que los núcleos atómicos son miles de veces más pesados que los electrones que los rodean y son por tanto más difícilmente desplazables las fuerzas interatómicas que aparecen al combinar átomos neutros se deben al desplazamiento de los electrones.
Enlaces químicos
[editar]Se distinguen dos tipos fundamentales de enlacen químicos, según los electrones se desplacen completamente de un átomo a otro (enlace iónico) o se compartan entre átomos (enlace covalente). Cuando los electrones se comparten entre muchos átomos se forma el enlace metálico.
Enlace iónico
[editar]
Al desplazarse los electrones de un átomo a otro se forman iones de carga contraria: un catión (de carga positiva) y un anión (de carga negativa). La diferencia entre las cargas de los iones provoca entonces una fuerza de interacción electromagnética entre los átomos que los mantiene unidos.
En una solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como "Na+ + Cl- " mientras que los cristales de cloruro de sodio se marcan "Na+Cl- " o simplemente "NaCl".
Algunas características de los compuestos formados por este tipo de enlace son:
- Forman redes cristalinas separadas entre sí.
- Altos puntos de fusión.
- Están formados por metales y no metales.
- Son solubles en disolventes polares.
- Una vez fundidos o en solución acuosa, sí conducen la electricidad.
- En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto ( a su signo ) de la pila del circuito y por ello este funciona.
Enlace covalente
[editar]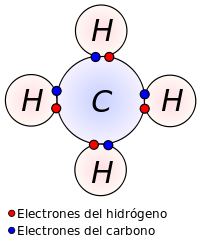
En general, cuando los átomos son distintos, los electrones compartidos no serán atraídos por igual, de modo que estos tenderán a aproximarse hacia el átomo más electronegativo, es decir, aquel que tenga una mayor apetencia de electrones. Este fenómeno se denomina polaridad (los átomos con mayor electronegatividad obtienen una polaridad más negativa, acercando los electrones compartidos hacia su núcleo), y resulta en un desplazamiento de las cargas dentro de la molécula.
Se podría decir que al átomo más electronegativo no le gusta mucho compartir sus electrones con los demás átomos, y en el caso más extremo, deseará que el electrón le sea cedido sin condiciones formándose entonces un enlace iónico, de ahí que se diga que los enlaces covalentes polares tienen, en alguna medida, carácter iónico.
Como propiedades de los compuestos formados por este tipo de enlace destacan:
- Forman redes cristalinas separadas entre sí.
- Bajos puntos de fusión en compuestos de pocos átomos, pero es alto para sólidos covalentes macromoleculares.
- Están formados por no metales.
- Son solubles en disolventes polares.
- Su capacidad conductora es prácticamente nula.
Enlace metálico
[editar]
El enlace metálico es característico de los elementos metálicos, es un enlace fuerte, primario, que se forma entre elementos de la misma especie.
Los átomos, al estar tan cercanos unos de otros, interaccionan los núcleos junto con sus nubes electrónicas empaquetándose en las tres dimensiones, por lo que quedan rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica. Presentan brillo y son maleables.
Las características básicas de los elementos metálicos son producidas por la naturaleza del enlace metálico. Entre ellas destacan:
- Suelen ser sólidos a temperatura ambiente pero hay casos en los que no como el Hg (Mercurio) y el Fr (Francio) que son líquidos.
- Sus puntos de fusión suelen ser elevados.
- Las conductividades térmicas y eléctricas son muy elevadas. (esto se explica por la enorme movilidad de sus electrones de valencia)
- Presentan brillo metálico.
- Son dúctiles y maleables. (la enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse sin producir una situación distinta, es decir, una rotura)
- Pueden emitir electrones cuando reciben energía en forma de calor.
- Tienden a perder electrones de sus últimas capas cuando reciben cuantos de luz (fotones), fenómeno conocido como efecto fotoeléctrico.
