Asimilación de nitrógeno en plantas
Contexto histórico
[editar]Inicios del estudio de la nutrición vegetal
[editar]La nutrición de las plantas ha sido del interés del hombre desde tiempos inmemoriales: la adopción de un modo de vida sedentario dependiente de la agricultura significaría que el conocimiento sobre relacionado al bienestar de las plantas se viese ligado directamente a la supervivencia (Morot-Gaudry, 2001).

Se sabe que ya Aristóteles creía que las plantas recibían una nutrición “preformada” de los suelos que les permitía crecer y desarrollarse. Más tarde, el alfarero, ingeniero hidráulico y naturalista Bernard Palissy, en el Siglo XVI, hizo observaciones sobre la importancia de las “sales” y propuso que la acción de abonar los campos con excremento animal restablecía las substancias que cultivos anteriores habían extraído (Carles, 1967).
Teoría del Humus y Teoría Mineral
[editar]A finales del Siglo XVIII, Hassenfratz y Thaer propusieron esta teoría. En ella se proponía que las plantas obtenían la nutrición necesaria para su crecimiento a partir de las substancias orgánicas presentes en el suelo. Las substancias inorgánicas presentes en el mismo se consideraban impurezas sin mayor relevancia (Morot-Gaudry, 2001).
No sería hasta 1840 cuando Von Liebig, basándose en observaciones de Saussure y Boussingault, descartó la teoría del humus y estableció la nutrición vegetal como un fenómeno puramente mineral (inorgánico). En los años siguientes, diferentes botánicos lograron hacer crecer plantas en medios hidropónicos artificiales y demostraron que la función principal de las raíces era la absorción de nitrógeno, fósforo, potasio y otros elementos minerales (Boulaine, 1990).
Darwin y la nutrición vegetal
[editar]
Otro personaje que merece mención por sus trabajos en este rubro es Charles Darwin, quien en 1875 publicó un extenso tratado sobre las plantas insectívoras (On Insectivorous Plants).
A Darwin le intrigaba este grupo en particular porque, según su teoría, debería haber una razón importante para que una planta invirtiera tal cantidad de energía en volverse llamativa para los insectos, atraparlos, envolverlos y degradarlos. Ya para ese entonces se tenía bien establecido que la absorción de nutrientes en las plantas se llevaba a cabo a partir de sales minerales, y Darwin se dio cuenta de que estos organismos crecían en ambientes pobres en ellas. Con la minuciosidad que lo caracterizaba, Darwin se dedicó durante 16 años a hacer experimentos en los que observó el efecto de una variedad de agentes, desde saliva, sales de amonio y trozos de carne hasta astillas de vidrio y cartílago de oreja de gato, sobre las glándulas de ejemplares de Drosera, Pinguicula y Dionaea muscipula.
Estos experimentos llevaron a Darwin a la conclusión de que las glándulas de estas plantas eran increíblemente sensibles a compuestos nitrogenados, mismos que eran absorbidos y causaban cambios intracelulares que él interpretó como la “agregación del protoplasma”. Con ello conjeturó que las plantas capturaban animales para asimilar el nitrógeno en ellos, digiriéndolos en un medio ácido “similar al estómago” para formar sales nitrogenadas que podían absorber (Darwin, 1975).
Siglo XX: estudio de los elementos bioquímicos en la nutrición vegetal
[editar]Con el surgimiento de la bioquímica y, más tarde, de la biología molecular, el estudio de la nutrición de las plantas ganó una nueva dimensión. En 1924, Anderson observó que el contenido de nitrato en las plantas variaba como una función de las condiciones de crecimiento, y demostró que extractos de papa poseen una enzima capaz de reducir el nitrito a nitrato. Eckerson, el mismo año, observó que extractos de tomate tenían la misma propiedad en ausencia de oxígeno. Los avances en el campo serían compendiados por Nightingale en 1937, describiéndose el almacenamiento y reducción del nitrato en los órganos vegetales y la influencia de factores externos (por ejemplo, pH, luz y temperatura) e internos (por ejemplo el pH intracelular, la concentración de azúcares y la etapa de crecimiento) sobre estos procesos.
En 1951, Delviche utilizó 15N para rastrear su asimilación en el tabaco, y a partir de entonces se trabajó en la extracción y purificación de la nitrato reductasa, logro alcanzado por Nicholas y Nason en 1955. En los años 60s y 70s, los grupos de Hageman y Losada (1960; 1975) caracterizaron y describieron la regulación de la enzima. Finalmente, los primeros mRNAs de la enzima fueron aislados por Crawford et al., Cheng et al. y Commere et al. en 1986.
Fuentes inorgánicas de nitrógeno
[editar]
El nitrógeno es uno de los elementos más abundantes en el Universo, y compone el 78% de la atmósfera terrestre (Morot-Gaudry & Touraine, 2001). La mayor parte de este elemento está presente en su forma gaseosa, que es casi completamente inerte en condiciones normales, por lo que se utiliza en la industria para la conservación de productos perecederos, para proteger componentes electrónicos de la atmósfera oxidante del planeta (Gagnon, 2016) e inclusive para inflar los trenes de aterrizaje de los aviones, evitando condensación de agua a grandes alturas o su combustión al aterrizar (Chelius, 2005). No obstante, también es uno de los componentes principales de los seres vivos, formando parte esencial tanto del material genético como de las proteínas.
De todos los nutrientes minerales, el nitrógeno es el que mayor efecto tiene en el crecimiento de la plantas y, por lo tanto, en la productividad primaria de los ecosistemas, lo que afecta a su vez a todos los organismos que dependen de ellas (Campbell & Reece, 2007): el aumento en el rendimiento de las cosechas a partir de que se comenzaron a utilizar fertilizantes nitrogenados en el siglo XIX lo demuestra (Grignon et al., 2001). A pesar de la gran cantidad de nitrógeno atmosférico, este elemento es limitante: pocos organismos pueden asimilarlo en esta forma. Las plantas solamente pueden asimilarlo eficientemente forma de iones amonio (NH4+) o nitrato (NO3-) (aunque también pueden absorber pequeñas cantidades de aminoácidos y urea (Grignon et al., 2001)).
Nitrato
[editar]La principal ruta de incorporación de nitrógeno a muchas cadenas alimenticias es por la absorción de iones nitrato a través de las raíces de las plantas terrestres (Grignon et al., 2001).
Absorción en la raíz
[editar]
Experimentos con colorantes que no pueden atravesar la membrana celular (Erwee & Goodwin, 1995) y observaciones anatómicas de una mayor cantidad de plasmodesmos entre las células epidérmicas que de éstas al córtex han resultado en evidencia de que existe una barrera entre estas dos capas, y sugieren que los nutrientes, incluyendo los iones nitrato, entran a las células vegetales principalmente en las células parenquimatosas del córtex. Esto sucede en toda la longitud de la raíz, aunque existe un pico de absorción en el ápice (Morot-Gaudry & Touraine, 2001).
La absorción de este nutriente es de tal importancia para la planta que existen genes (por ejemplo, el ANR1, identificado en Arabidopsis thaliana) que se activan con su presencia y codifican factores de transcripción involucrados en la proliferación de raíces laterales hacia su fuente. Por otro lado, cuando la planta como un todo tiene un suplemento suficiente de nitrógeno, el crecimiento de las raíces laterales se inhibe. Esto sugiere que coexisten dos mecanismos regulatorios: uno localizado que promueve el crecimiento de raíces laterales y otro sistémico que lo inhibe (Zhang et al., 1999).
El proceso de absorción de nitrato es un proceso que utiliza energía, que se ha cuantificado en 1-3 moléculas de ATP por mol del ion. Se cree que existe, como con otras rutas metabólicas, un “ciclo fútil”, en el que se disipa energía al escapar parte del nitrato ya absorbido, aumentando el gasto energético total (Devienne et al., 1994). La absorción de nitrato, además, resulta en la alcalinización del medio alrededor de la raíz, lo que sugiere el cotransporte de iones H+ o su intercambio por iones OH- o HCO3- (Grignon et al., 2001).
Las plantas poseen numerosos tipos de transportadores de nitrato, divididos en dos categorías:
- HATS: los sistemas de transporte de alta afinidad, o High Affinity Transport Systems, pueden transportar los iones inclusive cuando su concentración es baja, en el rango de solamente diez micromoles por litro. Estos sistemas son, sin embargo, muy sensibles a la temperatura y a inhibidores metabólicos (Glass et al., 1990). Estos transportadores son codificados por genes de la familia NRT2, y son polipéptidos de alrededor de 500 amino ácidos con 12 dominios transmembranales (Crawford & Glass, 1998).
- LATS: los sistemas de transporte de baja afinidad o Low Affinity ransport Systems, operan solamente cuando el substrato se encuentra en el medio en concentraciones relativamente altas, y son menos sensibles a los factores que afectan a los HATS (Glass et al., 1990). Éstos son codificados por genes de la familia NRT1 (Crawford & Glass, 1998).
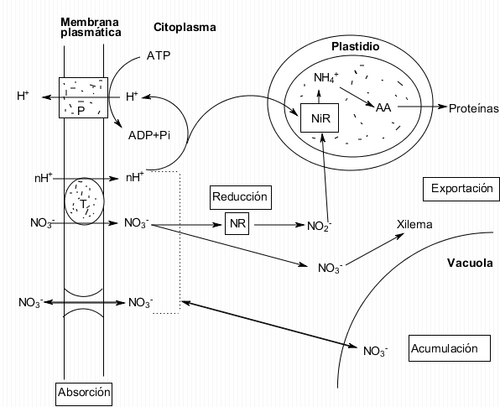
Transporte y almacenamiento
[editar]Una vez absorbido, el nitrato puede ser exportado al xilema, reducido en las raíces, almacenado en vacuolas o, en el llamado “ciclo fútil”, regresado al ambiente.
- Exportación al xilema: la transferencia del nitrato a través de la raíz ocurre a través de un gradiente radial de concentración en las células del córtex a través de los plasmodesmos, hasta las células parenquimatosas que rodean el xilema. Ahí, transportadores en la membrana plasmática de las células del estele secretan el nitrato al apoplasma gracias al potencial de membrana. La endodermis evita que el nitrato regrese al córtex, por lo que el gradiente siempre se mantiene (Touraine & Grignon, 1982).
- Almacenamiento en vacuolas: La inmensa mayoría del nitrato total almacenado en las células se encuentra en la vacuola, funcionando como reserva y participando en la turgencia de la célula. El proceso que lo introduce a ella consume ATP y genera una hiperpolarización de las células. El paso de los iones de regreso al citoplasma desde la vacuola es pasivo, a través de canales aniónicos.
Reducción
[editar]La enzima nitrato reductasa es aquélla que reduce al nitrato para su posterior conversión en aminoácidos y ácidos nucleicos. Esto puede suceder en diferentes órganos de las plantas: por ejemplo, en plantas herbáceas sucede principalmente en las hojas, mientras que en arbustos y árboles sucede en las raices (Gojon et al., 1992). Si esto sucede en la raíz depende de la competencia por el ion entre la nitrato reductasa, transportadores del tonoplasto (que lo almacenan en la vacuola) y transportadores en el estele (que lo secretan al xilema). La asimilación del nitrato incluye primero su reducción a nitrito por la nitrato reductasa en el citoplasma (Beevers & Hageman, 1969):
La nitrato reductasa es una proteína homodimérica. Cada monómero tiene una masa de 100 a 110 kDa, con tres cofactores: FAD, un grupo hemo del tipo citocromo b557 y molibdeno. Los monómeros están unidos entre ellos por puentes disulfuro (Faure et al., 2001).
Posteriormente, el nitrito se reduce a amonio en los plastos por la nitrito reductasa:
La nitrito reductasa es una enzima monomérica con una masa de 60-64 kDa, y posee un grupo prostético sirohemo y un grupo 4Fe-4S en el sitio activo (Faure et al., 2001). El amonio puede después ser incorporado a aminoácidos como grupos amina y amida.
Amoníaco
[editar]Aunque la mayor parte del nitrógeno absorbido por las plantas proviene del nitrato, normalmente en los suelos se encuentran tanto este ion como el amonio (NH4+), y los fertilizantes a menudo contienen una mezcla de ambos iones (Chaillou & Lamaze, 2001). Además, el nitrato se drena con mucha facilidad de los suelos (Madigan et al., 2012), por lo que las plantas han desarrollado formas de aprovechar el amonio en vez.
Absorción en la raíz
[editar]El amoníaco es una molécula pequeña, sin carga y lipofílica que puede cruzar fácilmente las membranas biológicas. Por ello, se supuso por mucho tiempo que simplemente entraba a las células por difusión, donde se metabolizaba rápidamente para mantener un gradiente de concentración que promoviera su entrada (Chaillou & Lamaze, 2001).
Al igual que para el nitrato, la absorción de amonio en la raíz sigue un comportamiento bifásico que depende de la concentración y es dependiente de energía: a bajas concentraciones (<1 mM) opera un sistema de baja capacidad y alta afinidad, o HATS, mientras que a altas concentraciones el aumento en el transporte es proporcional a la concentración y utiliza un sistema de alta capacidad pero baja afinidad, o LATS (Wang et al., 1994). Las proteínas que se encargan del transporte de este ion pertenecen a la familia AMT/MEP/Rh y, si bien se han encontrado funcionalmente expresadas y caracterizado parcialmente, su mecanismo de acción no se conoce con precisión (Ludewig et al., 2002). Algunas de las proteínas identificadas como responsables de introducir este ion a las células de las raíces incluyen a AtAMT1-6, que codifican un transportadores de alta afinidad con 501 aminoácidos y 9-12 regiones hidrofóbicas transmembranales en A. thaliana, así como su parálogo LeAMT1, reportado como uniporte en Lycopersicum esculentum (Ninnemann et al., 1994; Ludewig et al., 2002).
La absorción de amonio también causa la acidificación del suelo, probablemente por la salida de iones H+ al ambiente (Chaillou & Lamaze, 2001). Concentraciones excesivas de amonio y la ausencia de nitrato en el suelo causan lo que se conoce como síndrome amoniacal: la falta de nitrato causa un déficit de aniones minerales que no se puede compensar con la absorción de H2PO42- y SO42-, mientras que la absorción de amonio despolariza la célula y reduce la absorción de Ca2+ y K+ (Chaillou & Lamaze, 2001).
Transporte y almacenamiento
[editar]La mayoría del amonio que se absorbe en las raíces es asimilado en ellas: el ion es indetectable en el xilema excepto a concentraciones muy altas en el ambiente (Schobert & Komer, 1992) pero, a diferencia del nitrato, la mayoría se introduce al citoplasma (41%), comparado con un 20% almacenado en vacuolas, 19% metabolizado y 20% perdido de regreso al ambiente (Wang et al., 1993). En experimentos en los que se privó a las plantas de nitrógeno por períodos determinados de tiempo, se observó que, al terminar el período de deficiencia, las plantas absorbían amonio dos veces más rápido que nitrato y luego dejaban de absorberlo casi por completo por varios días (Rideout et al., 1994). Esto se debe a la alta acumulación de aminoácidos en las raíces durante las primeras horas de exposición, que después se transfirieron muy lentamente a las partes aéreas: la secreción de los mismos al xilema es un paso limitante. Experimentos como éste demuestran que el amonio es una fuente de nitrógeno ineficiente aunque, en general, las plantas necesitan de ambas para adquirir nitrógeno eficientemente (Chaillou & Lamaze, 2001).
Asimilación
[editar]Dada la naturaleza tóxica de este ion, que anula los gradientes de protones y desacopla las reacciones de fosforilación, la continua asimilación o reasimilación de éste es vital para el metabolismo. La asparagina sintasa (AS), la glutamato sintasa (GOGAT), la glutamato deshidrogenasa (GDH) y la glutamina sintasa (GS) son las enzimas responsables de catalizar la incorporación del ion amonio adquirido directamente o de la reducción del nitrato a moléculas orgánicas en la forma de grupos amina o amida (Brugière et al., 2001):
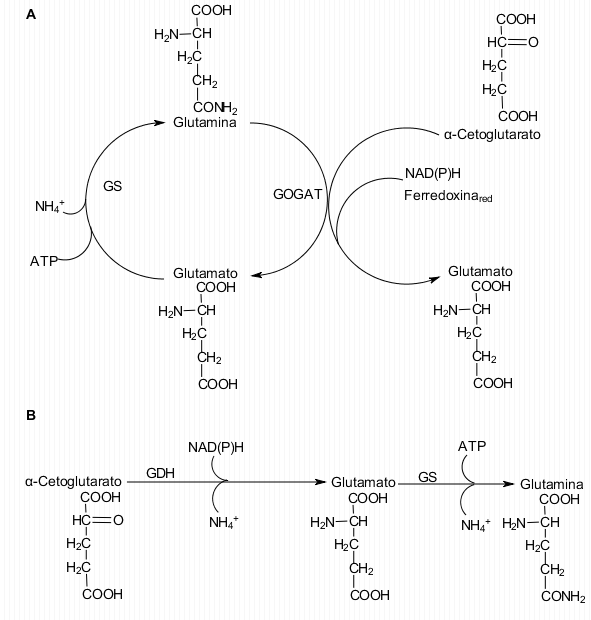
Se calcula que el 95% del amonio se asimila por el ciclo GS/GOGAT (Robinson et al., 1991). La glutamina sintasa es una proteína octamérica con una masa molecular de 350-400 kDa, y se han aislado dos isoformas, GS1 y GS2, con diferencias en estabilidad térmica, pH óptimo y afinidad por el glutamato y el ATP (Hirel et al., 1992). La glutamato sintasa, por otro lado, es una proteína monomérica que tiene dos formas: una que depende de NAD(P)H (NAD(P)H-GOGAT), de entre 130 y 80 kDa, y otra que depende de ferredoxina reducida (Fs-GOGAT), de entre 200 y 240 kDa (Brugière et al., 2001).
Fuentes simbióticas de nitrógeno
[editar]Fijación simbiótica de nitrógeno
[editar]Algunas plantas han establecido relaciones simbióticas con hongos y procationtes capaces de reducir el nitrógeno atmosférico a amonio, a cambio de lo cual reciben moléculas energéticas de la planta hospedera. Quizás el caso más conocido sea el de las bacterias del género Rhizobium con las leguminosas, pero también existen asociaciones con bacterias del género Frankia e inclusive algunas cianobacterias. Finalmente, también algunos hongos, llamados ectomicorrízicos, extienden sus filamentos más allá del alcance de las raíces, formando micorrizas que hacen más eficiente la absorción de elementos en el suelo en ambientes limitantes (Morot-Gaudry, 2001).
Asociaciones con bacterias
[editar]Se han identificado alrededor de 90 géneros de bacterias diazotróficas, que reducen el nitrógeno gaseoso a amonio, de las cuales algunas son capaces de establecer relaciones simbióticas con las plantas. Éstas incluyen a Frankia, un actinomiceto simbionte de muchas angiospermas (Trinchant et al., 2001), Nostoc, una cianobacteria que se aloja en plantas de la división Anthocerotophyta (Valencia & Ibarra, 2014), en dos especies de hepáticas (Blasia pusilla y Cavicularia densa) (Costa et al., 2001) y Cycadophyta (Lindblad, 2009), Anabaena azollae, que se establece en las frondas de los helechos del género Azolla (Muñíz & Eslava, 2014), Frankia, que vive en plantas no leguminosas como Casuarina (Madigan et al., 2012) y, finalmente, las bacterias de la familia Rhizobiaceae (Rhizobium, Sinorhizobium, Bradyrhizobium, Azorhizobium) con plantas leguminosas (Trinchant et al., 2001). Estos microorganismos contienen complejos enzimáticos llamados nitrogenasas, que en una reacción dependiente de energía son capaces de romper el fuerte triple enlace entre los átomos del nitrógeno atmosférico para formar amoníaco. El complejo también es capaz de reducir acetileno e hidrógeno (Trinchant et al., 2001):

Para funcionar, las nitrogenasas necesitan:
- Un substrato reducible
- Un reductor de bajo potencial
- Una fuente de ATP en la forma de un sistema que lo genere, debido a que el ADP inhibe la reacción
- Condiciones estrictamente anaeróbicas (Elmerich, 2001).
Nostoc
[editar]En las briofitas talosas, varias especies de Nostoc se alojan en cavidades mucilaginosas (Anthocerotophyta) o domacios (Marchantiophyta) en la superficie ventral del gametofito, formadas por éste previo a la infección y colonizada después por hormogonios de la bacteria: cada generación debe ser infectada de nuevo (Costa et al., 2001).

En las cícadas, por otro lado, se establecen en raíces coraloides, que emergen del suelo alrededor de la planta puesto que exhiben geotropismo negativo (es decir, crecen hacia arriba), aunque no se conoce exactamente el momento de la infección (Lindblad, 2009). Una vez establecidas en un anillo mucilaginoso dentro de la raíz, en el espacio intercelular entre células alargadas, las bacterias sufren algunos cambios respecto a sus homólogos de vida libre, incluyendo:
- Mayor frecuencia de heterocistos
- Mayores niveles de fijación de nitrógeno
- Transferencia de parte del nitrógeno fijado al hospedero
- Alimentación principalmente heterótrofa (debido a la falta de luz dentro de la raíz) (Lindblad, 2009).
Los heterocistos contienen la enzima nitrogenasa, que produce amonio a partir del nitrógeno atmosférico (Madigan et al., 2012). Normalmente, las cianobacterias asimilarían este nitrógeno a través de la vía GS-GOGAT. Cuando se encuentran en simbiosis, en vez, transfieren este nitrógeno al hospedero, principalmente en la forma de glutamina y citrulina (Zamiaceae) o glutamina y ácido glutámico (Boweniaceae y Cycadaceae), que se exportan al xilema para su transporte al resto de la planta (Lindblad, 2009).
Anabaena
[editar]
Los helechos acuáticos heterospóricos del género Azolla han sido utilizados desde el siglo XI en Vietnam y desde el siglo XIV en China como fertilizantes en los campos de arroz (Lumpkin & Plucknett, 1982), debido a su asociación simbiótica con Anabaena azollae. Esta cianobacteria reside en una cavidad basal en el lóbulo dorsal de cada hoja de Azolla, aunque también se encuentra asociado al meristemo terminal y a los megasporocarpos (Roger, 2001). Los filamentos de la bacteria tienen una frecuencia de heterocistos de 20 a 30% mayor cuando se encuentra en estas cavidades (Hills, 1975). La secreción de nitrógeno, en la forma de iones amonio que son absorbidos por la planta, se logra por la represión de la glutamina sintasa (Ray et al., 1978), y la habilidad de esta asociación de fijar nitrógeno eficientemente implica que puede sobrevivir inclusive en ambientes carentes de nitrógeno en forma mineral (Roger, 2001).
Frankia
[editar]
Las actinobacterias del género Frankia han establecido relaciones con alrededor de 220 especies (Santi et al., 2013) en varias familias de angiospermas, todas pertenecientes a las rósidas (Sprent, 2005), e incluyendo a los géneros Alnus, Casuarina y Myrica (Trinchant et al., 2001). Generalmente se encuentran en raíces laterales modificadas para formar nódulos leñosos con un alto contenido de taninos, lo que dificulta la extracción de enzimas y su cultivo puro. Además, debido a que las especies que poseen asociaciones con estas bacterias no son de importancia económica, esta asociación no ha sido estudiada a fondo (Sprent, 2005).
Frankia se encuentra en forma filamentosa, y puede sobrevivir tanto dentro de nódulos como en el suelo. Se cree que la identificación interespecífica es mediada por flavonoides secretados por la planta, que inducen a las bacterias a introducirse ya sea intracelularmente por los pelos de las raíces (Rosales) o intercelularmente (Fagales) (Santi et al., 2013). La fijación de nitrógeno atmosférico sucede en engrosamientos terminales de las células llamados vesículas. Éstas poseen paredes celulares gruesas de lípidos hopanoides que mantienen los niveles de oxígeno dentro lo suficientemente bajos como para no inhibir la acción de la nitrogenasa, de manera análoga a los heterocistos de las cianobacterias (Madigan et al., 2012). La célula también regula la concentración de oxígeno mediante la producción de hemoglobina (Santi et al., 2013). Una vez fijado por la nitrogenasa, una parte del nitrógeno se exporta a los tejidos vegetales para uso de la planta. Casuarina equisetifolia, que se utiliza para reclamar suelos desertificados por su resistencia y habilidad para enriquecerlos, fija en climas áridos un promedio de 15 kg de nitrógeno por hectárea por año, aunque se calcula que en climas templados esta cantidad podría ascender hasta a 300 kg de nitrógeno por hectárea por año (Wheeler & Miller, 1990).
Rhizobiaceae
[editar]

Existen más de 600 géneros de leguminosas, y una sola especie de ulmácea (Sprent, 2005), que contribuyen alrededor del 50% de las 175 millones de toneladas de nitrógeno fijado anualmente en el planeta, pero sólo algunos han sido sujeto de estudios por su relación con proteobacterias fijadoras de nitrógeno de los géneros Rhizobium, Bradyrhizobium, Sinorhizobium y Azorhizobium (Trinchant et al., 2001). Éstas se establecen en nódulos de las raíces, dentro de los cuales las células del hospedero endocitan a las bacterias, creando estructuras llamadas simbiosoma (Roth et al., 1988). Los nódulos poseen vascularización, que permite el abastecimiento de fotosintatos, en especial sacarosa, al tejido. La sacarosa es hidrolizada en glucosa y fructosa, que son después degradadas por glucólisis. El fosfoenolpiruvato intermediario de esta reacción es transformado por la fosfoenolpiruvato carboxilasa en malato, que es el sustrato energético para los bacterioides (células hinchadas y deformes) junto con el succinato producido por las mitocondrias y las azúcares presentes en el tejido (Deroche & Carrayol, 1988). Además, los niveles de oxígeno libre se mantienen bajos debido a la presencia de leghemoglobina dentro de los nódulos, que puede mantener una razón de oxígeno secuestrado contra libre en el orden de 10,000:1 (Madigan et al., 2012).

Las bacterias utilizan la nitrogenasa para producir iones amonio, que son expulsados al citoplasma de la célula. Ahí, es mediante la ruta GS-GOGAT, que produce dos moléculas de glutamato por ion amonio asimilado: una regenera el ciclo y la otra se convierte en aspartato por la acción de la aspartato aminotransferasa y, finalmente, en asparagina por la acción de la asparagina sintasa. La asparagina es la principal forma de transporte del nitrógeno fijado en leguminosas de climas templados (Trinchant et al., 2001). En climas tropicales también se ha observado otra ruta que utiliza purinas para producir ureidos como los ácidos alanoínico y alantóico con un gasto de energía mucho menor. (Schubert & Boland, 1984). El proceso entero de la fijación de nitrógeno está limitado por la producción de H2, por lo que algunas bacterias simbióticas como Bradyhizobium y Azorhizobium han desarrollado hidrogenasas que lo utilizan como fuente de poder reductor (Evans et al., 1987).

El establecimiento de las simbiosis entre Rhizobium, Bradyrhizobium y Azorhizobium con sus hospederos vegetales es un proceso complejo en el que las bacterias inducen dos procesos: la infección de las raíces de la planta y la organogénesis de los nódulos. Esta asociación también implica el reconocimiento específico de ambos miembros, con un espectro de huéspedes bien definido para cada especie de bacteria (Rosenberg, 2001). Las bacterias son atraídas hasta la planta por compuestos secretados por las raíces, que incluyen glucósidos, ácidos carboxílicos, aminoácidos y flavonoides. Después, migran hasta el ápice de los pelos de la raíz, donde son absorbidas y se agregan, penetrando en el tejido del pelo para formar un hilo tubular que llega al córtex de la raíz. Es en esta etapa que las células del interior del córtex forman meristemos que dan origen a nódulos, en el interior de los cuales las bacterias invaden las células para formar simbiosomas (Rosenberg, 2001), que consisten en un grupo de bacterioides rodeados por una membrana (Madigan et al., 2012).

Este proceso es modulado por dos grupos de genes en las bacterias. El primero incluye genes para la síntesis, ensamblaje y transporte de metabolitos como lipopolisacáridos (genes lps) y exopolisacáridos capsulares (genes exo), relacionados con el proceso de infección. El segundo incluye genes nod, nol y noe que son directamente responsables del reconocimiento específico, la infección y la nodulación en la planta hospedera. Estos genes son capaces de reconocer flavonoides producidos por los hospederos específicos, y producen factores Nod, que son tetra y pentasacáridos de residuos de N-acetil-glucosamina con enlaces β-1,4 con tres tipos de sustituyentes: un grupo sulfato en el glucósido reductor, un grupo O-acetil en el carbono 6 del glucósido no reductor terminar y un ácido graso de 16 carbonos con insaturaciones en las posiciones 2 y 9 en el átomo de nitrógeno del azúcar terminal no reductor (Rosenberg, 2001).
Algunas leguminosas forman nódulos en los tallos para evitar condiciones pobres en nitrógeno en el suelo. El ejemplo mejor estudiado es la asociación entre la legumbre acuática Sesbania y Azorhizobium caulinodans
Asociaciones micorrízicas
[editar]
Una micorriza es una relación mutualista entre las raíces de una planta y hongos en la que existe transferencia de nutrientes en ambas direcciones. El hongo provee a la planta nutrientes como fósforo y nitrógeno del suelo, mientras que la planta transfiere carbohidratos al hongo (Madigan et al., 2012).

Existen dos tipos de micorrizas. Las endomicorrizas, por un lado, penetran profundamente las células corticales para formar vesículas y arbúsculos dentro de las células del hospedero. Éstas se encuentran colonizando más del 85% de todas las plantas terrestres (Madigan et al., 2012), incluyendo algunas de importancia económica como maples y eucaliptos, y son formadas por zigomicetos como Gigaspora y Glomus (Martin & Plassard, 2001). Las mayoría de las endomicorrizas son del tipo arbuscular, que constituyen una división de hongos propia: Glomeromycota. Los arbúsculos son hifas dicotómicamente ramificadas que crecen dentro de las células del córtex interno de la raíz, cerca del tejido vascular, pero separadas del citoplasma del hospedero por una membrana celular extensa (Madigan et al., 2012).
Las ectomicorrizas, por el otro, forman una cubierta extensiva alrededor de la raíz formada por las hifas con poca penetración de los micelios en el tejido del hospedero (Madigan et al., 2012), y pueden representar tanto como el 30 o 40% de la masa total de las raíces (Smith & Read, 1997). Cientos de especies de basidiomicetos (por ejemplo, Amanita spp. Y Boletus spp.) y ascomicetos (por ejemplo, las trufas) forman este tipo de asociación con especies como pinos, encinos y hayas (Martin & Plassard, 2001), aunque se sabe que están asociados con otros grupos, incluyendo a las orquídeas, para las que juegan un rol esencial en la germinación y éxito de los individuos (Rasmussen, 2002). A diferencia de las asociaciones con bacterias, que suelen tener un alto grado de especificidad, un solo pino puede tener asociaciones con más de 40 especies de hongos. Esta falta de especificidad permite que las micorrizas provean conexiones entre árboles de diferentes especies para la transferencia de carbono y otros nutrientes (Madigan et al., 2012).
La asociación con ectomicorrizas incrementa considerablemente el volumen de suelo disponible para la absorción de nutrientes: hay alrededor de 1000 metros de micelios asociados a cada metro de raíz (Martin & Plassard, 2001). Las ectomicorrizas contribuyen de dos formas al mejoramiento de la nutrición de nitrógeno en el hospedero: primero, ponen a su disposición fuentes de nitrógeno, como aminoácidos, péptidos y proteínas, que son poco utilizadas normalmente por las plantas e incrementan la cantidad de nitrógeno mineral absorbido por el sistema radicular (Martin & Plassard, 2001).
Los hongos que forman micorrizas tienen la capacidad de utilizar nitrógeno orgánico proveniente de proteínas y taninos en la materia en descomposición como la única fuente de este elemento y transferirlo a su hospedero, característica expresada particularmente en ectomicorrizas de regiones boreales, donde la principal fuente de nitrógeno es el orgánico. Las micorrizas logran esto mediante la secreción de proteasas al medio, donde las proteína se degradan en péptidos y aminoácidos que el hongo incorpora a su tejido y utiliza (Read, 1991). Esta actividad proteolítica está limitada a los micelios que crecen fuera de los tejidos de la planta, mientras que se suprime en los micelios dentro de la raíz para evitar causar reacciones de defensa (Alexander, 1983).

Respecto al nitrógeno inorgánico, la presencia de micorrizas estimula la absorción de amonio y nitrato (France & Reid, 1983) El nitrito también puede ser reducido a nitrato, que a su vez es reducido rápidamente a amonio para ser incorporado a los aminoácidos del hongo previo a su transporte a la planta (Finlay et al. 1989). Esto se hace por dos rutas metabólicas que diferentes especies utilizan en diferentes proporciones, ambas dependientes de energía. La primera, que es igual a la presente en las plantas, es la ruta GS/GOGAT (glutamina sintasa / glutamato sintasa), que sintetiza una molécula de glutamina a partir de glutamato y un ion amonio, para luego transferir el nitrógeno asimilado a una molécula de α-cetoglutarato y producir dos moléculas de glutamato, regenerando el ciclo. La segunda es la secuencia GDH/GS (glutamato deshidrogenasa / glutamina sintasa), en la que se sintetiza una molécula de glutamato a partir de α-cetoglutarato y un ion amonio, que se utiliza junto con otro ion amonio para producir glutamina (Martin & Plassard, 2001). Esto causa una rápida y significativa acumulación de glutamina, seguida por la síntesis de alanina, aspartato, γ-aminobutirato e intermediarios del ciclo de la urea (ornitina y arginina) mediante una serie de transaminaciones (Martin & Botton, 1993), siendo la glutamina y la arginina las moléculas de reserva de nitrógeno por su alta proporción N:C (Martin & Plassard, 2001).
Las plantas controlan la actividad biosintética de los hongos al regular la transferencia de los esqueletos de carbono necesarios para sintetizar aminoácidos (Martin et al., 1992). A pesar de que la glutamina es el aminoácido más abundante resultado de la asimilación de amonio, la exportación de nitrógeno a la planta puede darse en la forma de otros aminoácidos, incluyendo a la alanina, por lo que hay altos niveles de actividad de amino transferasas en el hongo (Botton et al., 1994).
Otras fuentes de nitrógeno
[editar]Algunas plantas que habitan en ambientes limitantes, con poco nitrógeno inorgánico, y donde no se pueden desarrollar asociaciones con microorganismos que las ayuden a conseguirlo han desarrollado adaptaciones para obtener el nitrógeno necesario. Además, el hombre ha encontrado formas de suplementar la nutrición de las plantas por vías que no son las que se encuentran normalmente en la naturaleza.
Plantas carnívoras
[editar]Las plantas carnívoras son organismos capaces de capturar y digerir animales de pequeño tamaño, de los cuales extraen nutrientes como nitrógeno y fósforo. La mayoría habitan en suelos húmedos y ácidos pobres en nitrógeno inorgánico debido a tasas de descomposición bajas, y extraen nitrógeno de sus presas con eficiencias de entre 29 y 41%, además de ser sumamente eficientes en el reciclado de nitrógeno a partir de hojas senescentes (Hanslin & Karlsson, 1996).

La digestión de las presas puede suceder ya sea por medio de proteasas liberadas por la planta misma, por la actividad de organismos comensales que degradan los cadáveres o por una combinación de ambas. En algunas especies, por ejemplo, plantas del género Nepenthes, se han identificado al menos cuatro componentes enzimáticos secretados por la planta que forman una proteasa llamada nepenthesina (Frazier, 2000), que actúa en pH de 2.6 a 4.7 (Takahashi et al., 2007). La proteasa producida por Drosera peltata tiene la capacidad de romper enlaces peptídicos a ambos lados del ácido aspártico y el lado carboxílico de la alanina y la lisina (Amagase, 1972). En general, las plantas no son capaces de digerir la cubierta exterior de quitina de los insectos, aunque Eilenberg et al. (2006) reportan la presencia de quitinasas en Nepenthes khasiana. Una vez separadas las proteínas en aminoácidos, éstos pueden ser absorbidos por la planta para su asimilación al tejido.
Otras especies, como aquéllas del género Darlingtonia, Heliamphora, Roridula y Byblis (Hartmeyer, 1997) no poseen enzimas, por lo que la obtención de nitrógeno de sus presas depende en gran medida de su degradación por organismos comensales, incluyendo insectos, hongos y protistas. Los productos de la degradación, en forma de aminoácidos, iones amonio, nitritos y nitratos pueden ser absorbidos por la planta.
Fertilización artificial vía foliar
[editar]La fertilización de cultivos por medio de soluciones aplicadas a las hojas fue utilizada por primera vez en 1844 por Eusebe Gris para corregir deficiencias de hierro (Hochmuth, 2015). En años más recientes se han usado para introducir nitrógeno directamente a las hojas. La capacidad de éstas de absorber ciertos nutrientes se debe a la presencia de pequeños poros en la cutícula rodeados de cargas negativas capaces de permitir la entrada de moléculas pequeñas en disolución, en particular cationes como el ion amonio, y en menor medida partículas sin carga como la urea y aniones como el nitrato. Muchas soluciones contienen urea, que es altamente soluble y se absorbe rápidamente. Una vez dentro de la hoja, la ureasa la convierte en dióxido de carbono y iones amonio, que son utilizados para sintetizar aminoácidos (Bi & Scagel, 2007).
Integración del nitrógeno al tejido vegetal
[editar]Síntesis y transporte de aminoácidos
[editar]
Además de la ruta GS/GOGAT para la asimilación de iones amonio en glutamato, las plantas son capaces de llevar a cabo otras rutas de asimilación que producen alanina a partir de piruvato, aspartato a partir de fumarato u oxalacetato y asparagina a partir de aspartato, aspartato y glutamina o cisteína (Morot-Gaudry, 2001).
Además, para sintetizar otras familias de aminoácidos a partir de estos y otros precursores, las plantas pueden llevar a cabo una serie de reacciones de transaminación:

- Aspartato y α-alanina: se producen, respectivamente, por la transaminación del nitrógeno en el glutamato a una molécula de piruvato y una de α-alanina.

- Lisina, treonina, isoleucina y metionina: se producen a partir del aspartato mediante la acción de una serie de enzimas que someten al aspartato a una serie de fosforilaciones y reducciones.

- Ornitina, arginina y prolina: la ornitina se produce de la acetilación, fosforilación, reducción y transaminación del glutamato. La ornitina reacciona con carbamoíl fosfato para formar citrulina, que se condensa con ácido aspártico para formar ácido arginosuccínico. Éste se divide en ácido fumárico y arginina. La prolina se produce de la reducción de glutamato a glutamil-5-semialdehído, que se cicla y forma ácido 5-pirrolina carboxílico, que se reduce para formar prolina (Taylor & Stewart, 1981).


- Valina y leucina: se producen a partir de dos moléculas de piruvato, que se condensan en acetolactato para dar origen al 2-cetoisovaleriato. Éste se puede convertir en valina o en ácido α-cetoisocapróico, el precursor de la leucina (Singh & Shaner, 1995).

- Glicina y serina: se producen en el peroxisoma a partir del glioxilato producido por la fotorespiración. Éste es aminado para formar glicina, que se desamina y pierde una molécula de dióxido de carbono para formar serina.
- Cisteína y metionina: la cisteína se produce a partir de serina, que reacciona con acetil CoA para producir O-acetilserina, que en presencia de azufre se convierte en cisteína. La síntesis de metionina es más complicada, e implica la transsulfuración del grupo sulfuro de la cisteína (Morot-Gaudry, 2001).

- Triptófano, fenilalanina y tirosina: son producidos a partir de ácido shikímico, en el caso de la fenilalanina y la tirosina, mediante transaminación y, en el caso del triptófano, a través de su condensación con serina (Morot-Gaudry, 2001).
- Histidina: se sintetiza a partir de ribosa-5-fosfato, y es una ruta compleja que la transforma a 5’-PRFAR (N’-[(5’-fosforibosil)-formimino]-5-aminoimidazol-4-carboximida ribonucleótido), que también es el precursor de la síntesis de purinas. En presencia de glutamina, esta molécula se convierte en imidazol-glicerol-3-fosfato, que se convierte en imidazol aceto fosfato. Con glutamato, se transforma en histidinol fosfato, histidinol, histidinal y finalmente histidina (Morot-Gaudry, 2001).
- Ureidos: algunas legumbres tropiales transportan nitrógeno en forma de ureidos (alantoína y ácido alantoico), que son producto del catabolismo de purinas en los nódulos.
Los compuestos nitrogenados son a menudo la mayor parte de los solutos transportados en el xilema, en una proporción C:N de 1.5:6 (Peoples & Gifford, 1990). En plantas no leguminosas, la glutamina es el aminoácido más comúnmente transportado, mientras que las legumbres transportan ya sea alantoína y ácido alantoico o amidas, principalmente asparagina (Rochat, 2001).
En el floema, por otro lado, se transporta una menor proporción de nitrógeno, con C:N de 1:20 (Peoples & Gifford, 1990). Si bien la glutamina, el ácido glutámico, la asparagina y el ácido aspártico son los más transportados, algunas plantas transportan serina y prolina en grandes cantidades (Ziegler, 1975), así como aminoácidos no proteínicos como la homoserina y la citrulina (Pate, 1980).
El transporte a través de las membranas para la entrada y salida de estos aminoácidos a la célula puede ser llevada a cabo por difusión simple, difusión facilitada o transporte activo mediante simportes AA/H+ (Reinhold & Kaplan, 1984), que son el principal mecanismo para el movimiento de aminoácidos entre células.
Reservas de nitrógeno
[editar]El almacenamiento del nitrógeno sucede ya sea en forma de aminoácidos libres o proteínas, y depende de la especie cuál es la principal. Por ejemplo, en árboles de ciruela y durazno el nitrógeno se almacena principalmente en forma de aminoácidos, específicamente arginina y asparagina por su baja proporción C:N (Moreno et al., 1994, Taylor, 1967), mientras que en los manzanos la mayoría del almacenamiento se hace en forma de proteínas (Gaudillère, 2001). La mayoría del nitrógeno se reserva en el parénquima del córtex, la madera y las células fibrosas de los tallos y, en particular, de las raíces (Stepien et al., 1994).
En el caso de las semillas y granos, el nitrógeno llega a través del floema al embrión y los cotiledones en forma de glutamina, asparagina, serina, alanina, glutamato y aspartato (Moutot et al., 1986). Éstos pasan al apoplasto en el tejido materno, donde sufren transformaciones que, dependiendo de la especie, pueden crear pocos o numerosos aminoácidos a partir de los pocos transportados por el floema. Finalmente, estos se utilizan para formar proteínas en el retículo endoplásmico rugoso de las células del embrión. Las proteínas son la principal forma de almacenamiento de nitrógeno en la semilla, e incluyen albúminas, globulinas, prolaminas y glutelinas (Bènètrix & Autran, 2001).
Proteólisis en las plantas vasculares
[editar]La degradación de proteínas es un proceso que ocurre constante y selectivamente a lo largo de la vida de las plantas (Brouquisse et al., 2001). Durante la germinación, la hidrólisis de proteínas de almacenamiento provee los aminoácidos necesarios para la construcción de los tejidos (Preston & Kruger, 1986). La senescencia de órganos como hojas está acompañada de la degradación de proteínas para la exportación del nitrógeno contenido en ellas al resto de la planta, redistribuyendo el nitrógeno para su reciclaje (Peoples & Dalling, 1988). En plantas que habitan en ambientes limitantes en nitrógeno, por ejemplo, en plantas carnívoras, el reciclaje de los aminoácidos de hojas senescentes juega un rol vital al reducir la demanda de este elemento (Hanslin & Karlsson, 1996). En órganos no senescentes, la proteólisis ayuda a eliminar proteínas desnaturalizadas, inactivas o anormales, evitando su acumulación tóxica. Finalmente, también se necesita de este proceso para la modificación de proteínas, por ejemplo, en la maduración de enzimas (Vierstra, 1993).
Las proteínas que llevan a cabo este proceso se conocen como proteasas, peptidasas o hidrolasas proteínicas, y se pueden clasificar en exopeptidasas y endopeptidasas, dependiendo de si actúan preferentemente cerca de los extremos o en el interior de la cadena. Éstas se encuentran en casi todos los compartimientos de la célula (Brouquisse et al., 2001), pero la mayoría de las proteasas observadas en extractos de células vegetales provienen de la vacuola y no son dependientes de energía (aunque se requieren cantidades importantes de ésta para introducir las proteínas a la vacuola). Degradan a las proteínas introducidas a la vacuola de forma no específica (Seglen & Bohley, 1992).
Una de las rutas proteolíticas mejor entendidas es aquélla que involucra a proteasas dependientes de ubiquitina. La ubiquitina es una secuencia de 76 aminoácidos que se ha considerado la proteína más conservada entre los eucariontes (Brouquisse et al., 2001), y está involucrada en la proteólisis de más de 100 proteínas (Vierstra, 1993). La ubiquitina funciona como un marcador que se une covalentemente a las proteínas en un proceso dependiente de ATP, lo que a su vez permite que una proteasa dependiente de ubiquitina la hidrolice (Brouquisse et al., 2001).
Referencias
[editar]- Alexander, I. (1983). The significance of ectomycorrhizas in the nitrogen cycle. En: Nitrogen as an Ecological Factor. Lee, H., McNeill, S. & Rorison, I. (eds.). Oxford, Londres, Edimburgo, Boston y Melbourne: Blackwell Scientific Publications, 69-93.
- Amagase, S. (1972). Digestive enzymes in the insectivorous plants: III. Acid proteases in the genus Nepenthes and Drosera peltata, Journal of Biochemistry (Tokyo) 72:73-81.
- Anderson, V. (1924). Some observations on the nitrate-reducing properties of plants. Ann. Bot., 38: 699-706.
- Beevers L. & Hageman, R. (1969). Nitrate reductase: a target for molecular and cellular studies in higher plants. iTrends Genet., 6: 187-192.
- Bènètrix, F. & Autran, J. (2001) Protein Synthesis in Grains and Seeds. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Bi, G. & Scagel, C. (2007). Nitrogen foliar feeding has advantages. Nursery Management and Production: 43-46.
- Botton, B., Chalot, M., Garnier, A. & Martin, F. (1994). L’assimilation de l’azote mineral chez les plants. Plant Cell Environ., 9: 511-519.
- Boulaine, J. (1990). Deux siècles de fertilisation minérale. Deux siècles de progres pour l’agriculture et l’alimentation. París: Académie d’Agriculture de France, Technique et Documentation Lavoisier.
- Brouquisse, R., Fischer, A. & Raymond, P. (2001) Proteolysis in Higher Plants: Nature, Function and Regulation. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Brugière, N., Suzuki, A. & Hirel, B. (2001). Ammonium Assimilation. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Carles, J. (1967). La nutrition de la plante. París: Que sais-je? Presses universitaires de France.
- Campbell, N. A., & Reece, J. B. (2007). Biología. Madrid: Médica Panamericana.
- Chaillou, S. & Lamaze, T. (2001). Ammoniacal Nutrition of Plants. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Chelius, B. (2005). Airplane Wheel and Tire Servicing. Consultado el 02.12.16 en: http://www.boeing.com/commercial/aeromagazine/aero_05/textonly/m03txt.html.
- Cheng, C., Dewdney, J., Kleinhofs, A. & Goodman, H. (1986). Cloning and nitraate induction of nitrate reductase mRNA. P. N. Acad. Sci., USA, 83: 6825-6828.
- Commere, B., Chérel, J., Kronenberger, J., Galangau, F. & Caboche, M. (1986). In vitro translation of nitrate reductase messenger RNA from maize and tobacco and detection with an antibody directed against the enzyme of maize. Plant Science, 44: 191-203.
- Costa, J., Paulsrud, P., Rikkinen, J., & Lindblad, P. (2001). Genetic Diversity of Nostoc Symbionts Endophytically Associated with Two Bryophyte Species. Applied and Environmental Microbiology, 67(9), 4393-4396. doi:10.1128/aem.67.9.4393-4396.2001
- Crawford, N., Campbell, Q. & Davis, R. (1986). Nitrate reductase from squash: cDNA cloning and nitrate regulation P.N. Acad. of Sci., USA, 8073-8076.
- Crawford, N. & Glass. (1998). Molecular and physiological aspects of nitrate uptake in plants. Trends in Plant Science, 3: 389-395.
- Darwin, C. (1875) Insectivorous Plants. Londres: John Murray.
- Delviche, C. (1951). The assimilation of ammonia and nitrate ions by tobacco plants. J. Biol. Chem., 189: 167-175.
- Deroche, M. & Carrayol. (1988). Nodule phosphoenolpyruvate carboxylase: a review. Plant Physiol., 74: 775-782.
- Devienne, F., Mary, B., & Lamaze, T. (1994). Nitrate transport in intact wheat roots. II. Long term effects of NO3- concentration in the nutrient solution on NO3- unidirectional fluxes and distribution within the tissues. J. Exp. Bot., 45: 677-684.
- Eilenberg, H., Pnini, S., Schuster, S., Movtchan, A., & Zilberstein, A. (2006). Isolation and characterization of chitinase genes from pitchers of the carnivorous plant Nepenthes khasiana. Journal of Experimental Botany, 57(11), 2775-2784. doi:10.1093/jxb/erl048
- Elmerich, C. (2001). Nitrogenase: Biochemical, Molecular and Genetic Aspects. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Erwee, M.G. & Goodwin, P. (1995). Symplast domains in extrastellar tissues of Egeria densa Planch. Planta, 163:9-19.
- Evans, H., Harker, A., Papen, H., Russel, S., Hanus, E. & Zuber, M. (1987). Physiology, biochemistry, and genetics oft he uptake hydrogenase in Rhizobia. Ann. Rev. Microbiol., 41: 355-361.
- Faure, J., Meyer, C. & Caboche, M. (2001). Nitrate Assimilation: Nitrate and Nitrite Reductases. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Finlay, R., Ek, F., Odham G. & Söderström, B. (1989). Uptake, translocation and assimilation of nitrogen from 15N-labelled ammonium by Pinus sylvestris plants infected with four different ectomycorrhizal fungi. New Phytol., 110: 59-66.
- France, R. & Reid, C. (1983). Interactions of nitrogen and carbon in the physiology of ectomycorrhizae. Can. J. Bot., 61: 964-984.
- Frazier, C. (2000). The enduring controversies concerning the process of protein digestion in Nepenthes (Nepenthaceae). Carnivorous Plant Newsletter 29(2): 56-61.
- Gagnon, S. (2016). The Element Nitrogen. En It’s Elemental. Consultado el 02.12.16 en: http://education.jlab.org/itselemental/ele007.html.
- Gaudillère, J. (2001). Management of Nitrogen in Ligneous Species. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Gojon, A., Bussi, C., Grignon, C. & Salsac, L. (1992). Distribution of NO3 reduction between roots and shoots of peachtree seedlings as affecte by NO3- uptake rate. Plant Physiol., 82: 505-512.
- Glass, A., Siddiqi, Y., Ruth, J. & Rufty, W. 1990. Studies of the uptake of nitrate in barley. IV. Electrophysiology. Plant Physiol., 99:456-463.
- Grignon, C., Thibaud, J. & Lamaze, T. (2001). Transport of Nitrate by Roots. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Hageman, R & Flesher, D. (1960). Nitrate reductase activity in corn seedlings as affected by light and nitrate content of nutrient media. Plant Physiol., 35: 700-708.
- Hanslin, H. M., & Karlsson, P. S. (1996). Nitrogen uptake from prey and substrate as affected by prey capture level and plant reproductive status in four carnivorous plant species. Oecologia,106(3), 370-375. doi:10.1007/bf00334564
- Hartmeyer, S. (1997). Carnivory of Byblis revisited: A simple method for enzyme testing on carnivorous plants. Carnivorous Plant Newsletter, 26(2): 39-45 .
- Hill, D. (1975). The pattern of development of Anabaena in the Azolla-Anabaena symbiosis. Planta, 122: 179-184.
- Hochmuth, G. (2015). Ion (Fe) Nutrition of Plants. EDIS. University of Florida. Consultado el 13.12.16 en http://edis.ifas.ufl.edu/ss555.
- Lindblad, P. (2009). Cyanobacteria in Symbiosis with Cycads. Microbiology Monographs Prokaryotic Symbionts in Plants, 225-233. doi:10.1007/7171_2008_118.
- Losada, M. (1975). Metalloenzymes of the nitrate-reducing system. J. Mol. Catal, 1: 245-264.
- Ludewig, U., von Wirén, N.& Frommer, W. (2002). Uniport of NH4+ by the root hair plasma membrane ammonium transporter LeAMT1;1. JBC Papers in Press.
- Lumpkin, T. & Plucknett, D. (1982). Aolla as a Green Manure, Use and Management in Crop Production. EUA: Westview Press.
- Madigan, M., Martinko, J., Stahl, D. & Clark., D. (2012). Brock Microbiology of Microorganisms. Thirteenth Edition. Pearson.
- Martin, F. & Botton, B. (1993). Nitrogen metabolism of ectomycorrhizal fungi and ectomycorrhizas. Adv. Plant Pathol., 9: 83-102.
- Martin, F., Chalot, M., Bun, A., Lorillou, S., Botton, B. & Dell, B. (1992). Spatial distribution of nitrogen assimilation pathways in ectomycorrhizas. In: Mycorrhizas in Ecosystems. Read, D., Lewis, D., Fitter, A. & Alexander, I. (eds.). Wallingford: C.A.B. International, 311-315.
- Martin, F. & Plassard, C. (2001). Nitrogen Assimilation by Ectomycorrhizal Symbiosis. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Moreno, M., Gaudillère, J. & Moing, A. (1994). Potein and amino acid content in compatible and incompatible peach / plum grafts. J. Hort. Sci., 68:705-714.
- Morot-Gaudry, J (ed). (2001). Nitrogen Assimilation by Plants. Einfield: Science Publishers, Inc.
- Morot-Gaudry, J. (2001). Synthesis of Amino Acids. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Morot-Gaudry, J. & Touraine, B. (2001). Sources of Nitrogen, Nitrogen Cycle, Root Structure, and Nitrogen Assimilation. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Moutot, G., Huet, J., Morot-Gaudry, J. & Pernollet, J. (1986). Relationship between photosynthesis and protein synthesis in maize. I. Kinetics of translocation of the photoassimilated carbon from the ear leaf to the seed. Plant Physiol., 80: 211-215.
- Muñíz, M. & Eslava, F. (2014). Monilophyta. En Introducción a las embriofitas. Ciudad de México: Fomento Editorial, UNAM.
- Nicholas, D. & Nason, A. (1955). Role of molybdenum mas a constituent of nitrate reductase from soybean leaves. Plant Physiol., 30: 135-138.
- Ninnemann, O., Jauniaux, J. & Frommer, W. (1994). Identification of a high affinity NH4+ transporter from plants. The EMBO Journal. 13(15): 3464-3471.
- Pate, J. (1980). Transport and partitioning of nitrogenous solutes. Ann. Rev Plant Physiol., 31: 313-340.
- Peoples, M. & Dalling, M. (1988). The interplay between proteolysis and amino acid metabolism during senescence and nitrogen reallocation. En. Senescence and Aging in Plants. Noodén, L. & Leopold, A. (eds.). Academic Press Inc., 181-217.
- Peoples, M. & Gifford, R. (1990). Long-distance transport of nitrogen and carbon from sources to sinks in higher plants. En: Plant Physiology, Biochemistry and Molecular Biology. Dennis, D. & Turpin, D. (eds.). Longmann, 434-447.
- Preston, K., & Kruger, J. (1986). Mobilization of monocot protein reserves during germination. En: Plant Proteolytic Enzumes, vol. 2. Dalling, M. (ed.). CRC Press Inc., 1-8.
- Rasmussen, H. (2002). Recent developments in the study of orchid mycorrhiza. Plant and soil 244: 149-163.
- Ray, T., Peters, G., Toia, R. & Mayne, B. (1978). Azolla-Anabaena relationship. VII. Distribution of ammonia-assimilating enzymes, protein, and chlorophyll between host and symbiont. Plant Physiol., 62: 463-467.
- Read, D. (1991). Mycorrhizas in ecosystems. Experientia, 47: 376-391.
- Reinhold, L. & Kaplan, A. (1984). Membrane transport of sugars and amino acids. Ann. Rev. Plant Physiol., 35: 45-83.
- Rideout, J., Chaillou, S., Raper, D. & Morot-Gaudry, J. (1994). Ammonium and nitrate uptake by soybean during recovery from nitrogen deprivation. J. Exp. Bot., 45: 23-33.
- Rochat, C. (2001). Transport of Amino Acids in Plants. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Roger, P. (2001). Rice Field Cyanobacteria: Ecology, Contribution to Soil Fertility, and Practical Utilisation. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Roth, E., Jeon, K. & Stacey, G. (1988). Homology in endosymbiotic systems: the term “symbiosome”. En Molecular Genetics of Plant Microbe Interactions. Palacios, R. & Verma, D. (eds.). EUA: American Phytopathology Society Press, 220-255.
- Rosenberg, C. (2001). Symbiotic Signals in Rhizobium. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Santi, C., Bogusz, D., & Franche, C. (2013). Biological nitrogen fixation in non-legume plants. Annals of Botany, 111(5), 743-767. doi:10.1093/aob/mct048
- Schobert, C. & Komor, E. (1992). Transport of nitrate and ammonium into the phloem and the xylem of Ricinus communis seedlings. Plant Physiol., 25: 805-812.
- Schubert, K. & Boland, M. (1984). The cellular and intracellular organization of the reactions of ureide biogenesis in nodules of tropical legumes. En: Advances in Nitrogen Fixation Research. Veeger, C. & Newton, W. (eds.). Pudoc Wageningen: Nijhoff, 445-451.
- Seglen, P. & Bohley, P. (1992). Autophagy and other vacuolar protein degradation mechanisms. Experientia, 48: 158-172.
- Singh, B. & Shaner, D. (1995). Biosynthesis of branched chain amino acids: from test tube to field. Plant Cell., 7: 935-944.
- Smith, S.& Read, D. (1997). Mycorrhizal symbiosis. Londres: Academic Press.
- Sprent, J. (2005). Biological Nitrogen Fixation Associated with Angiosperms in Terrestrial Ecosystems. En Nutrient Acquisition by Plants. Ecological Studies, Vol 181. BassiriRad (ed.). Berlin: Springer-Verlag.
- Stepien, V., Sauter, J. & Martin, F. (1994). Vegetative storage proteins in woody plants. Plant Physiol. Biochem., 32: 185-192.
- Takahashi, K., Tanji, M. & Shibata, C. (1996). Variations in the content and isozymic composition of nepenthesin the pitcher fluids among Nepenthes species. Carnivorous Plant Newsletter, 36(3): 73-76.
- Taylor, A. & Stewart, G. (1981). Tissue and subcellular localization of enzymes of arginine metabolism in Pisum sativum. Biochem. Biophys. Res. Commun., 101: 1281-1289.
- Taylor, B. (1967). The nitrogen nutrition of peach trees. I. Seasonal changes in nitrogenous constituents in mature trees. Aust. J. Plant Physiol., 20: 379-387.
- Touraine, B., & Grignon, C. (1982). Energetic coupling of nitrate secretion into the xylem of corn roots. Physiol. Vég., 20: 33-39.
- Trinchant, J., Drevon, J. & Rigaud, J. (2001). Symbiotic Nitrogen Fixation. En Nitrogen Assimilation by Plants. Morot-Gaudry (ed.). Einfield: Science Publishers, Inc.
- Valencia, S. & Ibarra. (2014). Anthocerotophyta. En Introducción a las embriofitas. Ciudad de México: Fomento Editorial, UNAM.
- Vierstra, R. (1993). Protein degradation in plants. Ann. Rev. Plant Physiol. Plant Mol. Biol., 44: 385-410.
- Wang, M., Siddiqi, M., Ruth, J. & Glass, A. (1993). Ammonium uptake by rice roots I. Plant Physiol., 103: 1259-1267.
- Wang, M., Glass, A., Shaff, J. & Kochian, L. (1994). Ammonium uptake by rice roots III. Plant Physiol., 104: 899-906.
- Wheeler, C. & Miller. I. (1990). Current potential uses of actinorhizal plants in Europe. En The biology of Frankia and actinorhizal plants. Schwintzer & Tjepkema (eds.). San Diego, CA: Academic Press, 365-389.
- Zhang, H., Jennings, A., Barlow, P. & Forde, B. (1999) Dual pathways for regulation of root branching by nitrate. Proc. Natl. Acad. USA, 96: 6529-6534.
- Ziegler, H. (1975). Nature of transported substances. En: Encyclopedia of Plant Physiology, New Series, Vol. I. Transport in Plants. Zimmerman, M. & Milburn, H. (eds.). Berlín: Springer-Verlag, 59-100.









