Bioquímica/Cadena de Transporte de Electrones
Introducción[editar]
Luego que la glucosa u otros intermediarios metabólicos pasan a través de Glucolisis y el Ciclo del Krebs, tenemos que la ganancia neta de la Glicólisis es de 2 ATP, y en el ciclo de Krebs sólo obtenemos 1 ATP de ganancia. Recordemos la ecuación de oxidación total de glucosa por combustion:
y recordando además que un ATP entrega aproximadamente 30 kJ/mol, hemos recuperado 90 kJ/mol de un potencial energético sobre 2800 kJ/mol... entonces, la pregunta es:
Si analizamos brevemente la ecuación de combustión, será evidente que la ecuación nos indica que los electrones pasaron directamente a O2 reduciéndolo a H2O, pero esta reacción no ocurre en forma tan directa en la naturaleza y los 12 pares de electrones que se liberaron en la oxidación de la glucosa no se transfieren directamente al oxígeno, sino que se transfieren a las coenzimas NAD+ y FAD para formar NADH y FADH2 respectivamente. De ésta manera:


| Reducen | Enzimas |
|---|---|
| NAD+ | Gliceraldehido-3-fosfato deshidrogenada
Complejo de la Piruvato deshidrogenasa |
| FAD | Succinato deshidrogenasa |
Luego de la Glicólisis y del ciclo de Krebs, los electrones pasa a la cadena transportadora de electrones, un sistema de transportadores de electrones ubicado en la membrana interna mitocondrial, que actúan secuencialmente. La cadena de transportadores puede ser descrita como un gran proceso de 3 eventos, que son:
- Transferencia de los electrones del NADH y FADH2 a otras sustancias, donde finalmente se reoxidan a NAD+ y FAD para seguir participando en mas reacciones redox.
- Los electrones transferidos participarán en la oxidación-reducción secuencial de +10 centros redox en 4 complejos enzimáticos, antes de reducir el O2 a H2O.
- Durante la transferencia de los electrones, los H+ liberados por las coenzimas, serán expulsados de la matriz mitocondrial al espacio intermembrana, y creando una gradiente entre ambas. Finalmente, la ΔG de ésa gradiente electroquímica conducirá la síntesis de ATP a partir de ADP y Pi a través de la fosforilación oxidativa.
La Mitocondria[editar]
La mitocondria es el sitio del metabolismo oxidativo eucariótico

Estructura de la Mitocondria
| Estructura | Características |
|---|---|
| Membrana Externa | Permeable a moléculas pequeñas e iones. Posee canales de porina |
| Membrana Interna | Impermeable a la mayoría de moléculas pequeñas e iones, incluso H+ (permeable a O2, CO2 y H2O).
Tiene:
|
| Matriz mitocondrial | Tiene:
|
Transporte mitocondrial[editar]
Puesto que la membrana interna es prácticamente impermeable a cualquier metabolito, se genera una gradiente iónica (fuerza protón-motriz) que resulta en la compartimentalización de funciones metabólicas entre el citosol y la mitocondria, por tanto, se requieren sistemas que permitan ingresar metabolitos hacia la matriz. Existen 4 formas de hacerlo, 2 formas mediante enzimas y las 2 restantes como sistemas mas complejos denominados "shuttle" o lanzaderas.
- ADP-ATP translocasa
- Fosfato translocasa
- Shuttle malato-aspartato: Es el shuttle mas activo en las mitocondrias del hígado, corazón y pulmón. El Oxaloacetato citosólico se reduce a malato y entra a la matriz por un transportador (carrier), donde se reoxida a oxaloacetato y se transamina a Aspartato que sale de la matriz para convertirse nuevamente en oxaloacetato.

- Shuttle Glicerol-fosfato:Imagen Este shuttle cede los equivalentes de reducción desde el NADH a la ubiquinona y de ella al Complejo III. La 3-fosfoglicerol-deshidrogenasa cataliza la oxidación de NADH del citosol por dihidroxiacetaona-fostafo para así obtener NAD+, que volverá a la glicólisis. De ésta forma, los electrones del 3-fosfoglicerol resultante se llevarán a la flavoproteína-deshidrogenasa para formar FADH2, la que suministra electrones directamente a la cadena transportadora.
La Cadena de transporte de electrones[editar]
La cadena transportadora consiste de una serie de transportadores que actúan secuencialmente y que están unidos a la membrana interna. Los transportadores son proteínas integrales de membrana con grupos prostéticos capaces de aceptar y/o donar 1 o 2 electrones.
Los transportadores realizan 3 tipos de transferencias en todo éste proceso:
- Transferencia directa de electrones (asociada a metales)
- Transferencia de átomo de hidrógeno → H+ + e-
- Transferencia de ión hidruro → H- (H+ + 2e-)
Existen 5 tipos de moléculas transportadoras de electrones en éste proceso:
- NAD+ y NADP+
- Flavoproteínas
- Ubiquinona
- Proteínas Ferro-sulfuradas
- Citocromos
NAD+ y NADP+[editar]


La mayor cantidad de electrones es provisto de las enzimas de tipo deshidrogenasas, presentes en las vías catabólicas, y los envían a nucleótidos de amina o flavina.
NAD+ y NADP+ son carriers electrónicos solubles que pueden acoplarse reversiblemente a las deshidrogenasas, y que son incapaces de atravesar la membrana interna mitocondrial, pero son capaces de aportar sus electrones a la cadena transportadora de manera indirecta.
El NADH lleva sus electrones al Complejo I o NADH-deshidrogenasa, y el NADPH otorga electrones a variadas reacciones anabólicas en nuestro organismo.
Si observan atentamente las ecuaciones, verán que tanto NAD+ y NADP+ son aceptoras de grupos hidruros (H-)
Flavoproteínas[editar]


Son proteínas que poseen flavin-mononucleotidos (FMN) o Flavin-adenin-dinucleotido (FAD) unidos de forma covalente a su sitio activo. El nucleótido de flavina oxidado puede aceptar 1 o 2 electrones, como semiquinona o FMNH2/FADH2 respectivamente. La transferencia electrónica ocurre, puesto que la proteína tiene un potencial de reducción mayor que el del compuesto oxidado.
Las flavoproteínas pueden actuar como intermediarios entre reacciones en las que se donan 2 electrones (como deshidrogenaciones) o 1 electrón (cómo la reducción de quinona a hidroquinona).
Ubiquinona[editar]

También llamada coenzima Q (CoQ o simplemente Q), la ubiquinona es una benzoquinona con una larga cadena lateral isoprenoide.
Su nombre viene del inglés UBIquitous QUINONE (Quinona ubicua u omnipresente)
Transformaciones químicas de la Ubiquinona:
La ubiquinona puede actuar como puente entre un dador de 2 electrones y un aceptor de 1 electrón, además, puesto que Q es una molécula pequeña e hidrofóbica, puede difundir a través de la membrana interna mitocondrial y actuar como una lanzadera (shuttle) de equivalentes de reducción entre otros transportadores menos móviles.
Proteínas Ferro-sulfuradas[editar]
Son proteínas que contienen Fe3+ asociado con azufre (S), sea éste inorgánico o como el encontrado en las cadenas laterales de Cisteína (Cys)...
Van de fórmulas sencillas donde participa 1 átomo de Fe3+, hasta motivos mas complejos donde actúan mas de 4 átomos de Fe3+.
| Imagen | Descripción |
|---|---|
| imagen | Centro de 1 Fe. Los enlaces a S corespondientes a Cys, no se nombran. |
| imagen | Centro de 2 Fe-2S |
| imagen | Centro de 4Fe-4S |
Proteínas de Rieske: variantes de las proteínas ferro-sulfuradas, dónde el Fe3+ se agrupa a 2 residuos de Histidina, en vez de Cisteína.
En la transferencia electrónica mitocondrial, actúan al menos 8 proteínas ferro-sulfuradas.
Citocromos[editar]
Los citocromos son proteínas que presentan un cofactor Hemo (Fe3+).
Existen 3 tipos de citocromos de interés en ésta etapa: citocromo a, citocromo b y citocromo c, los que son distinguibles por sus diferencias en el espectro de absorción de luz.
| Tipo de Citocromo | Imagen Grupo Hemo | λmax |
|---|---|---|
| Citocromo a | 
|
600 nm |
| Citocromo b | 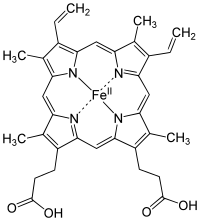
|
560nm |
| Citocromo c | 
|
550nm |
En los citocromos a y b, los cofactores Hemo están unidos fuertemente, pero no covalentemente con la proteína, mientras que en el citocromo c, el grupo hemo se une de forma covalente con la proteína mediante residuos de Cys.
El Potencial de reducción del Fe3+, en el grupo Hemo de los citocromos, depende de la interacción con las cadenas laterales de la proteína, por lo que es diferente para cada citocromo.
El citocromo a y b son proteína integrales de la membrana interna de la mitocondria, mientras que el citocromo c de las mitocondras es soluble, y se asocia de forma electrostática con la parte externa de la membrana interna.
Complejos de la Cadena Transportadora[editar]

Complejo 3mil plus[editar]

| Nombre | NADH Deshidrogenasa
NADH:ubiquinona óxido-reductasa |
| Masa Molar | 850 kDa |
| Subunidades Proteicas | 43 |
| Grupos Prostéticos | FMN, centros Fe-S |
| Inhibidores | Amital
rotenona Pieridicina A |
Este complejo cataliza dos procesos simultáneos acoplados
1.- Transferencia de hidruro y un protón a la ubiquinona. , ΔG = -
2.- Transferencia de 4 protones desde la matriz al espacio intermembrana (ΔG = +)
El complejo I es una bomba de protones, impulsada por la transferencia electrónica que cataliza una reacción vectorial.(mueve protones en una dirección específica desde un lugar a otro)
Los inhibidores del complejo actúan bloqueando el paso de electrones en los centros Fe-S.
El ubiquinol (QH2) difunde por la membrana del complejo I al complejo III, donde se exida a Q, en un proceso acompañado de la salida de electrones.
Complejo II[editar]

| Nombre | Succinato Deshidrogenasa |
| Masa Molar | 140 kDa |
| Subunidades Proteicas | 4 |
| Grupos Prostéticos | FAD, centros Fe-S |
| Inhibidores |
Es la única proteína periférica de éste proceso (está adherida hacia el lado interno de la membrana interna, o sea, hacia la matriz) y forma parte del ciclo de Krebs.
Posee 4 subunidades: 2 subunidades hacia la matriz: A y B (en la imagen, de amarillo y azul respectivamente) y 2 subunidades integradas en la membrana: C y D (en la imagen, de violeta y rojo respectivamente.
Ésta enzima transpasa electrones desde el succinato a la ubiquinona (Q), a traves de 1 molécula FAD, 3 centros Fe-S y un citocromo b.
Los complejos I y II no operan en secuencia, pero logran el mismo objetivo, traspasar electrones a la ubiquinona, desde sustratos reducidos.
Complejo III[editar]

| Nombre | Ubiquinona-citocromo C oxido-reductasa |
| Masa Molar | 250 kDa |
| Subunidades Proteicas | 11 |
| Grupos Prostéticos | Hemos, Fe-S |
| Inhibidores | Antimicina A |
Transfiere electrones desde QH2 (ubiquinol) a citocromo C, junto al transporte vectorial de protones (H+) desde la matriz al espacio intermembrana, por un proceso denominado Ciclo Q.
Ciclo Q: modelo de paso de electrones y protones a través del Complejo III, en 2 Ciclos. La esencia del ciclo Q es que QH2 pasa por una reoxidación bicíclica en donde QH (semiquinona) será un intermediario estable.
Reacción del primer ciclo:
En el primer ciclo, QH2 del complejo 1 se une al sitio Qo donde transfiere 1 electrón a la proteína ferro*sulfurada, librerando 2 H+ al espacio intermembrana y formando QH
La proteína ferro-sulfurada reduce el cit.C1 y QH transfiere sus electrones al cit.BL, formando Q. El cit.BL reducirá el cit.BH.
El Q formado es liberado del sitio Qo, y se une al sitio Qi, dónde adquire el electrón del cit.BH, formándose QH.
Reacción del segundo ciclo
En el segundo ciclo, otra molécula de QH2 proveniente del Complejo I, pasa por el proceso anterior, luego 1 electrón reduce la proteína Fe-S y el cit.C1. El otro electrón reduce secuencialmente el cit.BL y el cit.BH. Éste segundo electrón reduce el QH del primer ciclo, formando QH2. Los prorones consumidos en éste ultimo paso fueron originados de la matriz.
Reacción Global del Ciclo Q:
De e sta manera, por cada 2 moléculas de QH2 que entran al ciclo Q, se regenera 1 QH2
Complejo IV[editar]

| Nombre | Citocromo Oxidasa |
| Masa Molar | 160 kDa |
| Subunidades Proteicas | 13 |
| Grupos Prostéticos | Hemos, CuA, CuB |
| Inhibidores | CN- (cianuro)
Monoxido de Carbono. Acida de Sodio |
Transporta electrones desde el citocromo C a O2(Oxígeno molecular) formando H2O. Los electrones transportados siguen el siguiente camino:
Citocromo C → CuA → Hemo A → HemoA3-CuB → O2
Por cada 4 electrones que pasan por el complejo, la enzima consume 4H+ de la matriz, reduciendo el O2 en H2O, y usa la energía de ésta reacción pasando un H+ al espacio intermembrana por cada electrón que pasa por ella.
Reacción Global del Complejo IV:
Los intermediarios se amntienen fuertemente unidos la complejo hasta que se convierten completamente en H2O, y evitar la formación de radicales libres de oxígeno.
De ésta forma, la ecuación vectorial dada por todo el proceso de la cadena transportadora es :
La energía almacenada por éste gradiente, llamada fuerza protón-motriz, tiene 2 componentes:
- Energía Química Potencial: dada por la diferencia en las concentraciones de protones a ambos lados de la membrana interna
- Energía Eléctrica Potencial: originada con la separación de cargas, cuando un H+ cruza la membrana interna sin un contraión.
Síntesis de ATP[editar]
Teoría Quimiosmótica: La ΔG del transporte de electrones es conservada al bombear protones desde la matriz al espacio intermembrana para crear un gradiente electroquímico de H+ a través de la membrana interna. El potencial electroquímico de ésta gradiente se acopla a la síntesis de ATP.
Observaciones explicadas por la teoría quimiosmótica
- La fosforilación oxidativa requiere una membrana interna intacta.
- La membrana interna es impermeable a iones como H+, OH-, K+, Cl-, cuya difusión libre reduciría la gradiente electroquímica.
- El transporte de electrones resulta en el transporte de H+ fuera de la mitocondria intacta (el espacio intermembrana es equivalente al citosol), creando una gradiente electroquímica medible a través de la membrana interna.
- Los compuestos que incrementan la permeabilidad de la membrana interna a los H+ y disipan la gradiente, además, permiten que el transporte de electrones continúe, pero inhiben la síntesis de ATP, es decir, desacoplan el transporte de electrones de la fosforilación oxidativa. Al contrario, incrementando la acidez en el espacio intermembrana, la síntesis de ATP es estimulada.
ATP-Sintasa[editar]
La ATP-sintasa es una ATPasa de tipo F que contiene 2 componentes:
- F0: Canal de H+ transmembrana hidrofóbico que contiene al menos 8 subunidades proteicas (la zona de azules y violetas en la imagen)
- F1: Proteína periférica hidrosoluble, compuesta de 5 tipos de subunidades (la zona roja en la imagen).
EL Componente F0[editar]
- Su estructura no se conoce en detalle.
- Utilizando DCCD, un reactivo hidrofóbico, se bloquó el transporte de protones de F0 reaccionando con un residuo Glu (Ácido Glutamico, Glutamato a ph 7) en alguna subunidad de F0. Ésta reacción inplica que un grupo carboxilo se encuentra en un ambiente lipídico, o sea, está contenido en la membrana.
- Los mamíferos contienen 6 copias de proteínas ligadas a DCCD en su F0, que se cree se asocian como un barril, formando el canal de transporte de H+ polar que contiene residuos Glu.
El Componente F1[editar]
- Posee una composición proteica de tipo α3 β3 γ δ ε
- El arreglo cíclico y las estructuras similares de las subunidades α y β, le otorgan a ambas, simetría rotacional.
- Sin embargo, la proteína es asimétrica debido a la presencia de la subunidad γ, y además porque cada par de α y β adoptan conformaciones diferentes, cada una con una distinta afinidad por el sustrato.
- La subunidad β ctliza la síntesis de ATP, aunque la subunidad α también se adhiere al ATP.
- Las diferencias en la conformación de β son diferentes en los sitios de unión ATP/ADP. Ésta diferencia en la unión de nucleótidos en las 3 subunidades, son esenciales en el mecanismo del complejo.
Las conformaciones que adopta son las siguientes: β-ATP; β-ADP; β-vacía
Catálisis Rotacional[editar]
Los 3 sitios activos de F1 se alternan en la síntesis de ATP.
El mecanismo de síntesis de ATP, puede ser descrito en 3 pasos:
- Translocación de H+ por F0.
- Catálisis de Formación del enlace fosfoanhidrido del ATP por F1.
- Acoplamiento de la disipación de la gradiente protónica con la síntesis de ATP, que requiere la interacción de F1 y F0.
De acuerdo al mecanismo propuesto por Boyer, F1 tiene 3 protómeros catalíticos interactuantes (subunidades αβ), cada uno en un estado conformacional diferente: Uno que se une al sustrato y producto débilmente, llamado Estado L (loosely); otro que se une a éstos fuértemente, llamado Estado T (tight); y otro que no se une a ellos, llamado Estado O (open).













